Dihydrogène
| Dihydrogène | |

| |
| Identification | |
|---|---|
| Nom UICPA | dihydrogène |
| Synonymes |
hydrogène |
| No CAS | |
| No ECHA | 100.014.187 |
| No CE | 215-605-7 |
| PubChem | |
| No E | E949 |
| SMILES | |
| InChI | |
| Apparence | sans odeur, incolore, gaz comprimé[1] |
| Propriétés chimiques | |
| Formule | H2 [Isomères] |
| Masse molaire[2] | 2,015 88 ± 0,000 14 g/mol H 100 %, |
| Propriétés physiques | |
| T° fusion | −259,1 °C[3] |
| T° ébullition | −252,76 °C[3] |
| Solubilité | 21,4 ml dans 1 l d'eau (soit 1,92 mg/l) (0 °C)[4],[5] 8,5 ml dans 1 l d'eau (soit 0,76 mg/l) (80 °C)[4] |
| Paramètre de solubilité δ | 6,9 MPa1/2 (25 °C)[6] |
| Masse volumique | 0,089 88 g/l (gaz, CNTP), 0,070 8 kg/l (liquide, −253 °C), |
| T° d'auto-inflammation | 500 à 571 °C[1] |
| Point d’éclair | gaz inflammable[1] |
| Limites d’explosivité dans l’air | 4–76 %vol[1] |
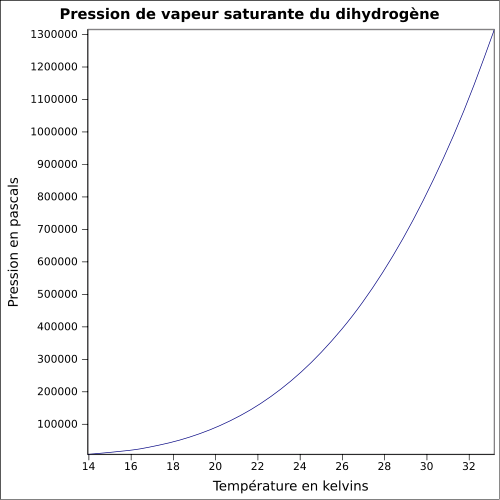
| Pression de vapeur saturante | |
| Point critique | 13,0 bar, −239,95 °C[8] |
| Point triple | −259,346 7 °C[9] ; 7,205 kPa abs |
| Conductivité thermique | 0,180 5 W m−1 K−1 à 16,85 °C[réf. souhaitée] |
| Vitesse du son | 1 310 m s−1 (27 °C, 1 atm)[10] |
| Thermochimie | |
| S0gaz, 1 bar | 130,68 J K−1 mol−1[réf. souhaitée] |
| ΔfusH° | 0,058 68[réf. souhaitée] |
| ΔvapH° | 0,90 kJ mol−1 (1 atm, −252,76 °C)[3] |
| Cp | 14 266 J kg−1 K−1 à 293 K[réf. souhaitée] |
| PCS | 285,8 kJ/mol (25 °C, gaz)[11] |
| PCI | 242,7 kJ/mol (10,82 kJ/l à pression atmosphérique)[12] |
| Précautions | |
| SGH[14] | |
| H220 |
|
| SIMDUT[15] | |
  A, B1, |
|
| NFPA 704 | |
| Transport | |
| Inhalation | suffocation |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le dihydrogène est la forme moléculaire de l'élément hydrogène qui existe à l'état gazeux aux conditions normales de température et de pression. La molécule comporte deux atomes d'hydrogène ; sa formule chimique est H2. Le dihydrogène est également appelé « hydrogène moléculaire » ou, à l'état gazeux, « gaz (d')hydrogène ». Dans le langage courant, lorsqu'il n'y a pas d'ambiguïté avec l'élément chimique du même nom, il est très fréquemment désigné simplement par « hydrogène », et l'on parle parfois simplement de « molécule d'hydrogène » pour la molécule de dihydrogène.
Il fut employé dans les ballons dirigeables de type zeppelin, utilisant les propriétés de la poussée d'Archimède, avant d'être remplacé par l'hélium, moins dangereux car non combustible. En 2021, la consommation mondiale d’hydrogène atteint 94 millions de tonnes. La majeure partie de la production de dihydrogène est consommée sur place, dans l’industrie chimique et pétrochimique principalement : synthèse de l'ammoniac (50 %), raffinage et désulfuration des hydrocarbures (37 %), synthèse du méthanol (12 %). Elle est réalisée à 99,9 % à partir d'hydrocarbures (méthane, pétrole, charbon) et pour 0,04 % par électrolyse de l'eau. Cette production s'accompagne en 2021 de l'émission de 900 millions de tonnes de CO2, soit environ 2 % des émissions mondiales.
C'est un gaz léger que la gravité terrestre ne peut retenir. Il brûle dans l'air en produisant de l'eau, d'où son nom composé par le préfixe « hydro », du grec ὕδωρ (hudôr) signifiant « eau », et par le suffixe « gène », du grec γεννάω / gennáô, « engendrer ». Il a notamment été utilisé pour la conservation de la viande. Le dihydrogène possède une température de vaporisation de 20,27 K et une température de fusion de 14,02 K. Sous de très fortes pressions, comme celles qui existent au centre des géantes gazeuses, ces molécules se dissocient et l'hydrogène devient un métal liquide. Dans l'espace, les nuages de H2 sont à la base du processus de formation des étoiles.
Historique modifier
Le premier scientifique connu à avoir décrit la production de dihydrogène est le Suisse Paracelse (1493-1541). Il fait cette découverte en versant de l'acide sulfurique sur de la poudre de fer, mais ne comprend pas la nature exacte du gaz dégagé au cours de l'expérience.
Le chimiste anglais Henry Cavendish (1731-1810), recommençant les expériences de Paracelse avec plusieurs métaux différents, découvre que le gaz ainsi produit est différent de l'air, est inflammable et a une faible densité. Il appelle ce gaz « air inflammable » (en anglais : inflammable air) et s'aperçoit que sa combustion produit de l'eau. Le dioxygène étant lui nommé « air vital ».
Le chimiste français Antoine Lavoisier, ayant confirmé les expériences de Cavendish, propose le mot hydrogène pour remplacer l'expression « air inflammable ». Ce mot est formé avec le préfixe hydro (du grec ὕδωρ / hudôr, « eau ») et du suffixe gène (du grec γεννάω / gennáô, « engendrer »). Le mot « hydrogène » signifie donc qui engendre l'eau.
Par la suite, dans le domaine scientifique, le mot « hydrogène » sera utilisé pour nommer l'élément chimique H et le mot « dihydrogène » sera utilisé pour la molécule H2.
Propriétés chimiques modifier
Test de reconnaissance modifier
Afin de tester la présence de dihydrogène, on approche une bûchette enflammée d'un tube à essai contenant du dihydrogène. La réaction chimique de combustion du dihydrogène avec le dioxygène de l'air, amorcée par la source de chaleur, produit un bruit caractéristique appelé « jappement » ou « aboiement ».
Combustion modifier
La combustion du dihydrogène dans le dioxygène, qui produit de l'eau, est 2 H2 (g) + O2 (g) → 2 H2O (l). Elle est particulièrement violente (voir test de reconnaissance) et très exothermique : son pouvoir calorifique est de 141,86 MJ/kg [ou 141,79 MJ/kg] (à 25 °C [ou 15 °C] sous 1 atm), soit une enthalpie de combustion standard, à 25 °C, de −285,84 kJ/mol, à 100 °C, de −283,45 kJ/mol (H2 gazeux, O2 gazeux, mais H2O liquide, comme pouvoir calorifique supérieur ou PCS), mais de 120,1 MJ/kg [ou 119,93 MJ/kg], soit une enthalpie de combustion, à 100 °C, de −242,8 kJ/mol (H2 gazeux, O2 gazeux, H2O vapeur, comme pouvoir calorifique inférieur ou PCI, en comptant 40,660 kJ/mol pour la vaporisation de l'eau à 100 °C), contre, par exemple, seulement 49,51 MJ/kg pour le butane. Cette propriété en fait un carburant de choix pour les engins spatiaux mais rend son stockage dangereux.
La même oxydation plus lente est utilisée pour produire du courant électrique dans les piles à combustible.
Formes ortho et para modifier
Le dihydrogène gazeux est un mélange de deux types de molécules isomériques qui diffèrent l'une de l'autre par le spin de leurs noyaux atomiques. Ces deux formes sont appelées ortho- et para-hydrogène, et la forme ortho (spins parallèles, état triplet) correspond à un état excité qui n'existe pas à l'état pur. Dans les conditions normales de température et de pression, par excitation thermique, l'hydrogène est composé à 75 % de la forme ortho et à 25 % de la forme para. À 77 K le mélange à l'équilibre (atteint spontanément en plusieurs jours, mais en quelques heures avec des catalyseurs) est à 50 %. À très basse température, la forme ortho se transforme entièrement en l'état para (spins antiparallèles, état singulet) avec le temps. Les deux formes ont des niveaux énergétiques légèrement différents et donc des propriétés physico-chimiques légèrement différentes. Par exemple, le point de fusion et le point d'ébullition du para-hydrogène sont environ 0,1 K plus bas que ceux de l'ortho-[réf. nécessaire].
Sources modifier
Le dihydrogène est un gaz très léger. Comme la gravité terrestre ne peut le retenir, il s'échappe naturellement de l'atmosphère terrestre. Par conséquent, il n'est présent que sous forme de traces (0,5 ppmv) dans l'air. Cette rareté atmosphérique fait que la totalité du dihydrogène utilisé est produit industriellement selon divers procédés, à partir de molécules où des atomes d'hydrogène sont chimiquement liés.
Cependant, il existe quelques contextes géologiques où le dihydrogène jaillit naturellement de la Terre[17]. L'on désigne le dihydrogène émanant de ces zones par le terme hydrogène naturel[18].
Hydrogène artificiel modifier
La production d'hydrogène fait appel à de nombreux procédés distincts, l'atome d'hydrogène formant nombre de molécules (eau, hydrocarbures, sucres, etc.).
En 2021, l'hydrogène est produit industriellement par divers procédés[19] :
- pour 62 % par vaporeformage à partir de méthane (voir Reformage du méthane) ;
- pour 19 % par gazéification du charbon ;
- pour 18 % comme sous-produit du reformage de naphta dans les raffineries ;
- pour 0,7 % par oxydation partielle du pétrole ;
- pour 0,7 % à partir d'énergies fossiles avec CCUS (capture, stockage et utilisation de CO2) ;
- pour 0,04 % par électrolyse de l'eau.
D'autres procédés sont aussi à l'étude, à partir du craquage ou de l'oxydation partielle, qui a l'avantage d'être exothermique[réf. nécessaire].
Méthode historique de production modifier
Historiquement, au XIXe siècle, le dihydrogène était obtenu par émission de vapeur d'eau (H2O) dans un tonneau rempli de limailles et copeaux de fer[20]. La vapeur d’eau oxydait le métal, créant d'un côté l’oxyde de fer, libérant du dihydrogène de l'autre. Ce dernier sortait ensuite du tonneau, où il était filtré dans un autre tonneau rempli d’eau, puis stocké directement dans un aérostat. Ce dispositif permettait à l’armée de gonfler n’importe où et en quelques heures un ballon d'observation.
Vaporeformage d'hydrocarbures modifier
Le vaporeformage d'hydrocarbures est le procédé qui, au début du XXIe siècle, est le plus utilisé au niveau industriel. Son principe repose sur la réaction d'hydrocarbures (méthane…) en présence de vapeur d'eau et de chaleur. La réaction globale s'écrit :
- .
Le rendement énergétique est de l'ordre de 40 à 45 % dans certaines installations[réf. nécessaire]. En pratique industrielle, il est nécessaire d'accélérer la réaction au moyen de catalyseurs ou de brûleurs. Elle a l'inconvénient de produire du dioxyde de carbone, un gaz à effet de serre.
Des technologies catalytiques, ou plus novatrices telles que les reformeurs à plasma, sont actuellement à l'étude.
Électrolyse de l'eau modifier
L'électrolyse de l'eau est une technologie qui consiste à faire passer un courant électrique (continu) dans de l'eau (à laquelle on a préalablement ajouté un électrolyte comme la soude caustique) afin d'obtenir la dissociation des molécules d'eau en dihydrogène et dioxygène.
Réaction à l'anode :
- 2 H2O (l) → O2 (g) + 4 H+ (aq) + 4 e−.
Réaction à la cathode :
- 4 H2O (l) + 4 e− → 2 H2 (g) + 4 HO− (aq).
Réaction dans l'eau :
- 4 H+ (aq) + 4 HO− (aq) → 4 H2O (l).
Réaction globale :
- 2 H2O (l) → 2 H2 (g) + O2 (g)
où (l), (g) et (aq) signifient respectivement « en phase liquide », « en phase gazeuse » et « en solution aqueuse ».
Cette technologie nécessite de grandes quantités d'électricité. Selon l'Ademe en 2020, le rendement de la chaîne hydrogène en Power-to-H2-to-Power est de 25 %, tandis que celui des batteries électriques est de 70 %[21]. Elle est donc relativement peu utilisée.
Oxydation partielle d'hydrocarbures modifier
La réaction d'oxydation partielle d'hydrocarbures est une combustion « riche » dans le sens où l'on vise la production d'un gaz riche en dioxygène H2 et monoxyde de carbone CO (gaz de synthèse) ; au lieu des produits « classiques » CO2 et H2O.
La réaction s'écrit :
- .
La plupart du temps, on utilise l'air comme comburant. On a alors :
- .
La réaction est exothermique, elle émet de la chaleur : par exemple, l'enthalpie de la réaction avec le méthane est de −35,7 kJ/mol.
Tout comme la réaction de vaporeformage, il est nécessaire de catalyser la réaction.
L'intérêt de la réaction d'oxydation partielle réside dans son caractère exothermique (contrairement à la réaction de vaporeformage) qui permet d'aider la catalyse (élévation de température).
L'inconvénient majeur réside dans le fait que les pourcentages de H2 sont inférieurs à ceux obtenus par vaporeformage, à cause de la présence majoritaire de l'azote de l'air. De plus, il y a un risque d'obtenir des NOx.
Action d'un acide sur un métal modifier
On produit du dihydrogène par action d'un acide sur un métal. Exemple :
- .
Action de l'hydroxyde de sodium sur l'aluminium modifier
On peut également produire du dihydrogène par la réaction d'hydroxyde de sodium avec de l'aluminium, selon la formule :
- .
Production par photosynthèse (cyanobactéries) modifier
Certaines cyanobactéries peuvent décomposer chimiquement l'eau en oxygène et hydrogène à l'aide de réactions photosynthétiques. Cela permettrait de produire de l'hydrogène à l'aide d'énergie solaire. Des recherches sont en cours dans ce domaine, notamment en génie génétique.
Hydrogène naturel modifier
L'hydrogène produit sur Terre naturellement, par opposition à l'hydrogène produit artificiellement par reformage d'hydrocarbures ou par électrolyse, est dit hydrogène naturel, hydrogène natif ou hydrogène blanc (dénomination commerciale)[réf. nécessaire].
La répartition, les capacités de production et les mécanismes physicochimiques de ses sources ou gisements font encore l'objet d'études exploratoires, au début du XXIe siècle. Ainsi, en avril 2019, le projet de recherche sen4H2 a été lancé et cofinancé par l'Agence spatiale européenne[22], il vise à détecter les émanations naturelles d'hydrogène grâce aux images satellites.
En 2020, le potentiel de production d'hydrogène naturel n'est pas quantifié précisément et, dans de nombreux pays, le droit minier ne prend pas en compte l'hydrogène. La détection d'hydrogène in situ est en effet récente et les outils sont à affiner[23], bien que des détecteurs plus performants aient été mis au point[24].
Sources d'hydrogène naturel modifier
La production de dihydrogène naturel au niveau de dorsales[25] est connue depuis les années 1970 et étudiée plus récemment[26]. Il s'agit de réactions de serpentinisation (oxydoréduction d'olivine) entre l'eau et les roches magmatiques affleurantes du manteau terrestre, facilitée par la chaleur de ces réactions exothermiques[27] : l'oxygène des molécules H2O capturé par le fer de la roche, les atomes d'hydrogène sont libres de s'associer en H2. Le dihydrogène ainsi produit s'échappe par des évents hydrothermaux et peut éventuellement réagir à son tour pour former du méthane, puis des hydrocarbures plus lourds[28]. Sous une grande profondeur d'eau, et souvent loin des continents, ces émanations ne peuvent en 2018 être exploitées de façon économique[29] mais leur équivalent géologique à terre, en l'Islande ou dans la république de Djibouti, sont prometteurs[24].
Des émissions d'hydrogène ont également été découvertes au milieu des cratons continentaux par le géologue russe Nicolay Larin, à la suite de son travail à propos de l'hypothèse de la Terre hydrurée[26]. L'IFP Énergies nouvelles a confirmé cette découverte en 2013, rapportant des émissions localement importantes, sur la plupart des continents, en Russie, aux États-Unis, au Brésil, à Oman ou au Mali[30] mais la source de l'hydrogène reste discutée.
De nombreux phénomènes, en particulier dus à l'interaction eau/roche, peuvent générer de l'hydrogène et le débat sur le mécanisme prépondérant qui pourrait engendrer de grandes accumulations n'est pas encore été tranché. Il pourrait s'agir d'hydratation de fer par de l'eau infiltrée, celui-ci étant présent dans les ceintures de roches vertes, présentes dans les cratons[31],[32]. Ainsi, au Kansas, près de Junction City, un gisement a été identifié dans les années 1980 et a fait l'objet d'un regain d'intérêt dans les années 2000[23] ; le dihydrogène y serait issu de telles réactions d'oxydation de fer[33]. En Russie, l'IFPen a estimé en 2010 à plusieurs dizaines de milliers de mètres cubes le débit quotidien d'une seule dépression, soit la consommation équivalente de 500 taxis[29]. Une origine géologique ou hydrogéologique prévaut également pour les dégagements d'hydrogène étudiés au Brésil, dans certains cercles de fées situés dans le bassin de São Francisco[34],[35],[36]. La radiolyse, séparation de la molécule d'eau par la radioactivité naturelle de la croûte, est aussi une source d'hydrogène, considérée par certains comme très importante sinon prépondérante[37].
À Yanartaş, en Turquie, les « feux millénaires » du Mont Chimère seraient la combustion d'un gaz composé de méthane (87 %), de dihydrogène (7,5 à 11 %) et de diazote (2 à 4,9 %), ayant une double origine : la serpentinisation d'une part, un gaz thermogénique d'autre part. Ils seraient la source originelle de la flamme olympique[38].
Le Mali est, en 2015, le seul pays où l'on exploite l'hydrogène naturel, dans le village de Bourakébougou, à 60 kilomètres au nord de Bamako[23]. Le gaz proviendrait selon certains d'une « surmaturation du pétrole » vraisemblablement enfoui à proximité[39], d'autres scientifiques pensent qu'il vient là aussi de l'interaction eau/roche[40]. Ses réserves sont estimées à environ 1,5 milliard de mètres cubes[réf. nécessaire]. La pression dans les puits ne diminue pas, le reversoir se remplit donc en permanence, ce qui permet la durabilité de cette exploitation[41].
De nombreuses émanation d'hydrogène ont été notées au-dessus des cratons archéens et protérozoïques, en particulier ceux riches en fer et l'exploration de l'hydrogène naturel s'accélère dans les pays qui en sont riches comme le Brésil[42]ou l'Australie[43],[44]
Enjeux modifier
Contrairement à l'hydrogène artificiel, qui nécessite de l'énergie pour être produit, ce qui le réduit à n'être qu'un vecteur d'énergie, l'hydrogène natif est une véritable source d'énergie[23],[45],[46], dont la combustion ne produit que de l'eau. De plus, des coproductions pourraient être possibles avec la géothermie ou l'extraction d'hélium, ce qui pourrait aider la filière à être compétitive[24].
Cet intérêt pour l'hydrogène naturel se concrétise dans les années 2020 par la prise de permis d'exploration dans plusieurs régions de France, d'Australie, des États-Unis[47]. Des investissements importants sont fait dans des compagnies d'exploration visant spécifiquement cette ressource.
Utilisations industrielles modifier
La consommation mondiale d’hydrogène est, en 2022, d’environ 100 millions de tonnes par an[19]. La majeure partie de la production de dihydrogène est consommée sur place, dans l’industrie chimique et pétrochimique principalement : synthèse de l'ammoniac (50 %), raffinage et désulfuration des hydrocarbures (37 %), synthèse du méthanol (12 %)[réf. nécessaire].
Les principales utilisations industrielles du dihydrogène sont :
- le procédé Haber-Bosch (production de l'ammoniac), l'hydrogénation des graisses et des huiles et la production de méthanol ;
- la fabrication de l'acide chlorhydrique, le soudage, les carburants pour fusées et la réduction de minerais métalliques ;
- l'utilisation sous forme liquide pour les recherches à très basses températures, y compris l'étude de la supraconductivité ;
- comme gaz traceur, pour effectuer des opérations de détection de fuite dans des domaines variés (raffinage pétrolier, automobile, installations de chauffage, réseau de distribution d'eau, réservoirs d'avions, etc.) ;
- comme additif alimentaire, autorisé sous le code E949, dans la catégorie des traceurs ;
- comme fluide caloporteur, dans certaines machines de haute puissance (alternateur synchrone de centrale par exemple) ;
- dans les aérostats, car il est quatorze fois moins dense que l'air, mais il a été remplacé par l'hélium pour des raisons de sécurité ; il est encore utilisé pour certains ballons-sondes dans des stations éloignées ;
- comme carburant pour l'aéronautique, essayé lors d'un vol le dans un Tupolev Tu-155[48].
Certains isotopes de l'hydrogène ont également une utilisation industrielle ou technologique particulière :
- le deutérium (2H) est utilisé dans les applications nucléaires comme modérateur (eau lourde ou D2O) pour ralentir les neutrons. Les composés du deutérium sont aussi utilisés en chimie et en biologie pour étudier ou utiliser l'effet isotopique ;
- le tritium (3H), un autre isotope, est produit dans les réacteurs nucléaires et est utilisé pour la construction de bombes atomiques. Il est également utilisé comme un marqueur isotopique dans les biosciences et comme source de radiation dans les peintures luminescentes ;
- le deutérium et le tritium sont aussi fusionnés dans des réacteurs de recherche et envisagés pour les projets de fusion nucléaire contrôlée sur Terre.
Pour des raisons de sécurité, des odorants doivent être ajoutés au dihydrogène afin de détecter d'éventuelles fuites[49].
Stockage modifier
À ce jour, trois grandes voies de stockage d'hydrogène à bord d'un véhicule sont envisagées[50] :
- stockage sous forme de gaz comprimé ;
- stockage sous forme liquide à basse température ;
- stockage sous forme solide, l'hydrogène étant alors lié à d'autres composants (par adsorption ou sous la forme d'un composé chimique).
Gaz comprimé modifier
C'est la forme la plus commune de stockage du dihydrogène.
Le stockage gazeux sous forme comprimée (actuellement 350 bars) permet d'atteindre une densité massique satisfaisante avec des réservoirs composites. La densité volumique de stockage reste faible : une pression de 700 bars est inévitable pour rendre la technologie compétitive.
La technologie existe et est couramment utilisée. Son inconvénient réside dans l'énergie nécessaire à la compression et dans la faible efficacité en termes d'encombrement en comparaison aux autres méthodes. Cet encombrement est une des difficultés pour l'utilisation du dihydrogène sous forme de gaz comprimé dans les applications automobiles.
Une fois comprimé, la masse volumique du dihydrogène à 20 MPa (200 bars) est d'environ 16,8 kg/m3, à 35 MPa (350 bars) d'environ 23 kg/m3 et à 70 MPa (700 bars) d'environ 38 kg/m3. Cela correspond à une densité volumique d'énergie de 767 kWh/m3 (= 2,8 GJ/m3 = 2,8 MJ/l à 27 °C et sous 35 MPa), avec toujours une densité massique d'énergie de 33,313 9 kWh/kg (= 119,93 MJ/kg = 241,764 kJ/mol de pouvoir calorifique inférieur ou PCI), mais de 39,405 6 kWh/kg (= 141,86 MJ/kg = 285,973 kJ/mol de pouvoir calorifique supérieur ou PCS).
Stockage liquide (cryogénique) modifier
Le stockage liquide à 20 K (−253 °C) sous 10 bars permet d'atteindre des densités volumique et massique intéressantes mais nécessite des réservoirs à l'isolation thermique poussée afin de minimiser l'évaporation.
La technologie est existante. Elle a une meilleure efficacité volumique que le stockage de gaz comprimé (70 kg/m3 contre 10 kg/m3 à 115 bars et 0 °C). Cependant, cet avantage est modéré par le volume relativement important des enceintes isolantes nécessaires.
D'autre part, il faut une énergie importante pour passer en phase liquide : la liquéfaction consomme 30 à 40 % du contenu énergétique du gaz et la déperdition en utilisation réelle est importante (actuellement 1,25 pour mille par heure[51]), pénalisant fortement le stockage au-delà d'une semaine.
Cette technique est notamment utilisée dans le domaine spatial où, malgré le faible délai de mise en œuvre, le remplissage est continu jusqu'au dernier moment.
Hydrures métalliques modifier
Le stockage sur des substrats sous forme adsorbée, notamment sur des hydrures métalliques, présente une densité volumique très intéressante mais une densité massique faible. De plus, la cinétique, la température et la pression de cyclage restent des points durs à maîtriser.
Les atomes d'hydrogène sont stockés dans certains composés métalliques. On récupère le dihydrogène en chauffant ou en diminuant la pression. Cette technique est aujourd'hui mal maîtrisée. Elle a l'inconvénient de demander un dihydrogène extrêmement pur afin d'éviter de détruire la capacité d'absorption des hydrures. Le chauffage pour récupérer le gaz est également un handicap. Ce type de stockage, qui continue de faire l'objet de recherches, est au stade du développement industriel et certains projets démonstrateurs[52] sont prévus, par exemple avec la start-up McPhy qui développe la technologie d'hydrure de magnésium (technologie issue du CNRS, institut NEEL).
Capacité de stockage de certains hydrures.
| Hydrure | Pourcentage massique de H2 contenu |
|---|---|
| LaNi5H6,5 | 1,4 |
| ZnMn2H3,6 | 1,8 |
| TiFeH2 | 1,9 |
| Mg2NiH4 | 3,6 |
| VH2 | 3,8 |
| MgH2 | 7,6 |
Un métal très étudié est le palladium qui, sous la forme de son hydrure PdH2, a la capacité d'absorber une large quantité d'hydrogène au sein de son réseau cristallin. À température ambiante et pression atmosphérique, le palladium peut absorber jusqu'à 900 fois son volume d'hydrogène gaz, le processus étant réversible[53].
Stockage par adsorption sur du carbone modifier
L'adsorption sur du carbone permet de stocker en surface de certaines structures de carbone, telles que du charbon actif ou des nanotubes, les molécules de dihydrogène. Elle permet de stocker 0,05 à 2 % en masse de dihydrogène[réf. nécessaire].
Ce type de stockage est au stade de recherche.
Production et usages modifier
Dans un rapport publié en , l'Agence internationale de l'énergie note la polyvalence de l'hydrogène comme vecteur énergétique, qui peut être produit à partir de tous les combustibles fossiles, des énergies renouvelables et du nucléaire, peut être transporté sous forme gazeuse ou liquide et être transformé en électricité ou en méthane pour un large éventail d'usages[54].
Classement par couleurs modifier
Les modes de production de l'hydrogène sont distingués par des noms de couleur[55],[56],[57], variables selon les pays faute de consensus :
- hydrogène brun ou noir, produit par gazéification du charbon ;
- hydrogène gris, produit par vaporeformage du méthane (mode de production le plus utilisé) sans séquestration géologique du dioxyde de carbone ;
- hydrogène vert :
- au sens large, produit sans émission directe de gaz à effet de serre (incluant donc l'hydrogène jaune, rouge, bleu, turquoise, orange ou blanc, détaillés ci-dessous),
- au sens restreint, produit par électrolyse de l'eau[58]. Il est par exemple produit par électrolyse de l'eau à partir d'électricité renouvelable, par thermolyse de la biomasse[59] ou, selon la terminologie du plan de relance français de 2020, à partir d'électricité bas carbone (de source renouvelable ou nucléaire)[60].
- hydrogène jaune : produit par électrolyse de l'eau à partir d’électricité d’origine nucléaire[61], il est rose pour certains[62],[63], ou violet pour d’autres[64] ;
- hydrogène rouge : produit à partir du nucléaire (réacteurs VHTR à très haute température) par dissociation catalytique de l'eau à haute température[65] ;
- hydrogène bleu : produit par conversion de combustibles fossiles avec capture et séquestration du dioxyde de carbone[66] ou, pour d'autres auteurs, à partir d'énergie bas carbone non renouvelable, par exemple par électrolyse de l'eau alimentée par l'énergie nucléaire[67] (soit l'hydrogène jaune ci-dessus) ;
- hydrogène turquoise : extrait du méthane par pyrolyse, sans émission directe de CO2[57],[68] ;
- hydrogène orange : obtenu par réaction de l'eau avec les roches du substratum, qui offre la possibilité de séquestrer géologiquement du dioxyde de carbone dissous dans l'eau injectée[69] ;
- hydrogène blanc : hydrogène natif ou naturel[70],[71].
En 2020, le coût de l'hydrogène gris se situe entre 1 et 2 €/kg contre 4 à 7 €/kg pour de l'hydrogène vert produit de façon industrielle. D'après Julien Chauvet, directeur Hydrogène France d'Engie Solutions, « le kilo permet de parcourir 100 km, ce qui le met à parité avec l’essence et s’approche du Diesel pour les véhicules légers »[73].
Production industrielle modifier
L'hydrogène est actuellement presque entièrement produit à partir de gaz naturel, de pétrole et de charbon.
Pour ses propres besoins, l'industrie produit de l'hydrogène (ex. : en France, plus de 900 000 t/an d'hydrogène, notamment pour la désulfuration de carburants pétroliers et pour fabriquer l'ammoniac des engrais nitratés ; l'hydrogène est alors un intrant chimique et non un vecteur énergétique). Le processus industriel le moins cher pour produire cet hydrogène, en 2018, est le reformage d'hydrocarbures, le plus souvent par vaporeformage du gaz naturel (lequel est essentiellement composé de méthane). À une température comprise entre 700 °C et 1 100 °C, la vapeur d'eau réagit avec le méthane en donnant du monoxyde de carbone et de l'hydrogène. La purification de l'hydrogène étant plus facile sous forte pression, le reformage est réalisé sous une pression de vingt bars. Le mélange hydrogène/monoxyde de carbone est communément appelé « gaz de synthèse ». Si la réaction est faite en présence d'un excès de vapeur d'eau, le monoxyde de carbone est oxydé au niveau d'oxydation supérieur, conduisant au dioxyde de carbone, ce qui augmente la production d'hydrogène.
La société Air liquide possède une maîtrise particulière de ce processus. En 2015, elle a mis en service en Arabie saoudite, sur le site de Yanbu, une unité ayant une capacité totale de production d'hydrogène de 340 000 m3/h aux CNTP[74].
En 2019, l'Agence australienne d'énergie renouvelable (en) (ARENA) a aidé à hauteur de 9,41 millions de dollars australiens (8,5 M€) un projet du groupe Hazer (compagnie d'énergie renouvelable australienne) visant à convertir du biogaz issu de méthanisation de boues d'épuration en hydrogène et en graphite. Hazer veut construire une usine démonstratrice de 15,8 millions de dollars US à Munster (Australie de l'Ouest)[75].
Filière hydrogène et enjeux environnementaux modifier
La production industrielle « traditionnelle » d'hydrogène à partir d'hydrocarbures fossiles a un mauvais bilan carbone et est très émettrice de gaz à effet de serre, atteignant 830 millions de tonnes de CO2 par an en 2020, soit environ 2 % des émissions mondiales, comparable à celle du secteur aérien ou du transport maritime[76] et 900 millions de tonnes de CO2 en 2021, soit également 2 %[77]. En France, ces émissions s'élèvent à presque dix millions de tonnes d'équivalent CO2 par an vers 2015-2017, soit 7,5 % des émissions de gaz à effet de serre de l'industrie française, d'après l'ADEME[78]. La production d'hydrogène à partir d'électricité renouvelable, plus vertueuse, pourrait voir son coût baisser de 30 % d'ici 2030 grâce à l'essor des énergies renouvelables et aux économies d'échelle liées[54].
L'hydrogène est lui-même un gaz à effet de serre indirect, de sorte que son utilisation contribue aussi au réchauffement climatique[79],[80]. En effet, une petite partie de l'hydrogène utilisé fuit dans l'atmosphère, où il prolonge la durée de vie du méthane et contribue à la production d’ozone troposphérique et de vapeur d'eau, d'autres gaz à effet de serre. Falko Ueckerdt, scientifique principal à l’Institut de recherche de Potsdam sur les effets du changement climatique, estime qu'une tonne d’hydrogène consommée pourrait laisser échapper entre 5 et 30 kg de ce gaz[81],[82],[83]. En dépit de ces inconvénients, le climatologue Didier Hauglustaine, directeur de recherche au laboratoire des sciences du climat et de l'environnement du CNRS, considère que l'économie hydrogène reste globalement bénéfique pour le climat[83]. Pour un taux de fuite compris entre 0 et 3 %, le recours à l'hydrogène vert permet d'éviter 90 à 99 % de l'équivalent CO2 des émissions de gaz à effet de serre[79],[84].
La filière hydrogène produit, stocke, promeut et valorise l'hydrogène et la recherche sur l'hydrogène. En 2015, des expérimentations d'hydrogène vert (décarboné) sont en cours, mais ce gaz est encore « majoritairement produit à partir de gaz naturel (fossile) et employé comme composant chimique dans des procédés industriels », avec un mauvais bilan carbone et une contribution notable à l'effet de serre. La filière pourrait néanmoins être intéressante pour le développement durable, car :
- le dihydrogène peut être fabriqué par électrolyse de l'eau de manière décarbonée puis stocké, éventuellement après conversion en gaz (méthanation), ou injecté dans le réseau de gaz (6 à 20 % en volume selon les conditions). Il peut ainsi valoriser les surplus d'énergie intermittente (éolien et photovoltaïque principalement)[29], « de l'ordre du terrawatt-heure par an » et jusqu'à plusieurs dizaines de térawatts-heures par an d'électricité selon l'ADEME, notamment en cycles inter-saisonniers, si le taux de pénétration des énergies renouvelables dans le mix électrique atteint 80 %[85]. Il facilite alors l'équilibre et la souplesse du réseau électrique et « [apporte] une contribution importante à la transition vers un modèle énergétique décarboné »[86] ;
- l'hydrogène peut servir à produire localement de l'électricité, au prix d'une perte de rendement ; celui de l'électrolyse de l'eau approche 70 %, mais le rendement global d'une production électrique à partir de H2 serait d'environ 25 % selon l'Ademe en 2020[21] ;
- l'hydrogène est compatible avec l'autoconsommation d'un logement, îlot ou quartier, permettant des stockages sur plusieurs jours, semaines ou mois, en complément de batteries plus utiles pour le stockage à court terme. Il serait déjà économiquement justifié[Comment ?] dans les zones non interconnectées au réseau électrique continental (ex. : îles isolées, collectivités française d'outre-mer où la production électrique dépend encore du fioul au coût élevé, à 225 €/MWh en moyenne en 2013 selon l'ADEME)[85] ;
- l'hydrogène peut alimenter certaines flottes de véhicules professionnels, sans requérir de réseau coûteux de plusieurs centaines de stations-service sur tout le territoire. Selon l'Ademe, « le modèle économique d’une station pour flotte est accessible pour une consommation journalière supérieure à 80 kg H2/j, pour une commercialisation de l’hydrogène à moins de 10 €/kg »[85]. Il a dans ce cas les avantages d'un temps de recharge rapide et d'une grande autonomie[73] ;
- l'hydrogène peut être utilisé dans la sidérurgie en remplacement du charbon ou du gaz naturel pour la réduction du minerai de fer. Recourir à ce procédé en France consommerait 700 000 tonnes d’hydrogène, mais éviterait l’émission[Comment ?] de 22 Mt CO2/an, soit près de 5 % des émissions du pays, indique l’Association française pour l'hydrogène et les piles à combustible (Afhypac)[73].
En Europe modifier
Le , la Commission européenne présente un programme pour le développement de l'hydrogène vert, fixant l'objectif que l'hydrogène couvre 12 à 14 % des besoins en énergie d'ici 2050 afin de décarboner certains secteurs de l'industrie et des transports. Elle compte sur l'hydrogène pour contribuer à la transition énergétique et à la réduction des émissions de gaz à effet de serre[87],[88]. Son but est de développer la demande et les capacités de production d’hydrogène vert par électrolyse de l’eau à partir d’énergie renouvelable : un objectif de six gigawatts (GW) est fixé pour 2024, et 40 GW en 2030[89]
En France modifier
L'ADEME envisage un mix électrique à 40 % composé de « renouvelables » en 2035, puis à 60 % et 70 % en 2050 (contre près de 18 % en 2017, alors en majorité de source hydroélectrique)[85].
La filière cherche à industrialiser ses processus pour diminuer ses coûts (notamment celui de la pile à combustible). Le développement d'une « mobilité hydrogène » est également freiné par un nombre encore très faible de stations de recharge (et de leur capacité encore faible : 10 à 80 kg H2/j à 350 bar). L'hydrogène peut améliorer la puissance du véhicule, prolonger son autonomie et améliorer la rapidité de recharge, par rapport aux batteries[86],[90].
L'Ademe juge que l'hydrogène aura un rôle important dans la transition énergétique, comme vecteur d'optimisation des réseaux énergétiques, pour stocker l'énergie dans l'autoconsommation solaire ou photovoltaïque, et pour certains véhicules professionnels, à condition de décarboner sa production grâce à une électrolyse utilisant une électricité non issue d'énergies fossiles, et à la transformation de la biomasse (vaporeformage de biogaz, pyrogazéification de biomasse solide). Le bilan environnemental de la filière dépendra surtout de « la source primaire utilisée pour fabriquer l'hydrogène ». L'agence invite à limiter à moins de cent kilomètres la distance de transport de l'hydrogène entre le point de fabrication et la station de distribution. Les véhicules à batterie restent à privilégier, lorsque c'est possible (autonomie, disponibilité, etc.), compte tenu du meilleur rendement de ce type de stockage, et les économies d'énergie restent une priorité[85]. L'une des pistes de développement (en cours de test en 2018/2019) est l'injection dans le réseau de gaz, en France via deux démonstrateurs : GRHYD et Jupiter 1000, pour lever les verrous techniques qui subsistent encore[86].
En , le gouvernement français mandate l'Ademe pour lancer le « plan national de déploiement de l’hydrogène » (ou « plan hydrogène »), afin de donner une impulsion à ce secteur dont le « fort potentiel » est perçu par les acteurs publics. Un an après, l'agence publique a réalisé de multiples appels à projets, dont « Écosystèmes de mobilité hydrogène », qui a permis de sélectionner des projets « sur tous les territoires » et diversifiés, comme « la livraison du dernier kilomètre en milieu urbain, le transport collectif de personnes en bus ou en navette maritime, la location de voitures, la collecte de déchets, les flottes d'entreprises et de collectivités, ou encore l'usage de poids lourds comme véhicules de chantier ».
Le CEA, promet une nouvelle technologie d'électrolyse industrielle, baptisée rSOC avec un seul métal précieux : l'Indium[91] (un métal utilisé dans les écrans LCD), avec de moindres températures (de 700 °C à 800 °C) et une moindre consommation électrique. Elle est également réversible, permettant de produire de l'hydrogène ou de restituer de l'énergie électrique telle une pile à combustible[92].
Fin 2019, Air liquide et Engie s'associent à Durance-Luberon-Verdon Agglomération (DLVA) pour produire, stocker et distribuer de l'« hydrogène vert » (dans le cadre du projet « HyGreen Provence » lancé en 2017, visant 1 300 GWh d'électricité solaire et plusieurs milliers de tonnes par an d'hydrogène produit par électrolyse. Plusieurs dizaines de milliers de tonnes d'hydrogène renouvelable par an pourraient être produites à terme, stockable dans une cavité saline locale[93].
La société française McPhy, qui a déjà installé 17 MW de capacité de production d'hydrogène par électrolyse sous pression, dont 6 MW chez Audi en Allemagne, annonce en la signature du contrat d'ingénierie d'un projet de production d'hydrogène vert industriel de 20 MW, le plus gros projet à ce jour en Europe, implanté à Delfzijl aux Pays-Bas d'ici 2022. L'usine produira 3 000 tonnes d'hydrogène par an par électrolyse de l'eau au moyen d'électricité éolienne et servira à la fabrication de bioéthanol. Le projet bénéficie de 15 millions d'euros de subventions de l'Union européenne et d'un fonds néerlandais. Selon McPhy, la bonne échelle sera de 100 ou 200 MW pour atteindre un prix compétitif dans l'industrie[94].
La loi Énergie Climat de novembre 2019 donne un an au gouvernement pour mettre en place un mécanisme de soutien destiné à « l’hydrogène produit à partir d’énergie renouvelable ou par électrolyse de l’eau à l’aide d’électricité bas-carbone ». Avant 2023, la programmation pluriannuelle de l'énergie vise l’objectif de décarboner 10 % de l'hydrogène consommé dans l’industrie, ce qui exige la production de 90 000 tonnes d'hydrogène vert. Le gouvernement lance en un appel à manifestation d’intérêt, destiné à tester l'appétence des industriels pour le sujet, qui reçoit plus de 160 projets. Par exemple, H2V Industry dépose en janvier les demandes de permis de construire pour deux usines de production d’hydrogène dans la zone industrielle de Port-Jérôme, en Normandie, et sur le grand port maritime de Dunkerque à partir d'électricité renouvelable ; si elles parviennent à bénéficier d’un mécanisme de soutien, leur mise en service pourrait intervenir en 2023-2024 et elles produiraient 56 000 tonnes d’hydrogène. Les grands acteurs industriels français (Engie, EDF, Air liquide, Vinci, etc.) se sont également positionnés[73].
Le gouvernement Jean Castex annonce en septembre 2020 un plan beaucoup plus ambitieux que celui présenté par Nicolas Hulot en 2018, doté de 100 millions d'euros : le plan 2020 prévoit de consacrer 7,2 milliards d'euros d'ici 2030 à l'hydrogène vert ou bas carbone, dont 2 milliards d'euros en 2021 et 2022 dans le cadre du plan de relance. Le gouvernement prévoit de subventionner la production d'hydrogène vert par le biais d'appels d'offres, sur le modèle des renouvelables, et la construction d'usines de piles à combustibles pour les véhicules à hydrogène. Des partenariats avec l'Allemagne, qui a dévoilé un plan hydrogène à 9 milliards d'euros en juin, sont envisagés afin d'éviter les doublons[95].
Ce plan hydrogène comprend un premier volet de 1,5 milliard d'euros consacré à la fabrication d'électrolyseurs, afin d'en réduire le coût en l'améliorant et en augmentant les volumes, pour une capacité de 6,5 GW. Le deuxième volet de près d'un milliard d'euros sera utilisé d'ici à 2023 pour développer une offre de mobilité lourde à l'hydrogène en réduisant le coût et en améliorant le rendement des piles à combustibles destinées aux trains, camions, bus et avions, via plusieurs appels à projet (350 millions d'euros pour des démonstrateurs, 275 millions pour des expériences territoriales, etc.). Enfin, l'aide à la recherche et l'innovation sera stimulée, avec une enveloppe portée à 650 millions d'ici à 2023. Bruno Le Maire espère que ce plan créera entre 50 000 et 150 000 emplois directs et indirects[96]. Le gouvernement envisage une coopération avec l'Allemagne qualifiée d'« Airbus de l'électrolyse » à l'image de l'« Airbus des batteries ». La France s'est fixé l'objectif de produire 600 000 tonnes par an d'hydrogène vert, à partir d'électricité décarbonée, d'origine renouvelable ou nucléaire. Contrairement à l'Allemagne, Paris ne subventionnera pas, en revanche, la capture du carbone issu de l'hydrogène « gris ». Bruno Le Maire espère voir « émerger une filière française de l'électrolyse » : à côté des géants comme Air liquide, les start-up sont aussi nombreuses, comme Lhyfe, basée à Nantes, qui développe des sites de production d'hydrogène vert pour des industriels et des collectivités locales, ou encore McPhy, producteur drômois d'électrolyseurs dont EDF est actionnaire[97].
En Belgique modifier
Une équipe de la KUL conçoit un prototype de cellule photoélectrochimique de 1,6 m2 produisant en moyenne 250 litres de dihydrogène par jour à partir de la vapeur d'eau atmosphérique. Le dispositif convertit 15 % de l'énergie solaire en dihydrogène et en dioxygène. Cette technologie ne fait pas appel à des métaux précieux ou autres matériaux coûteux. Avec vingt panneaux, une maison bien isolée serait autonome en électricité et en chauffage pendant un an[98],[99].
Colruyt Group (acteur belge important de la distribution) veut décarboner ses activités autant que possible. Un de ses centres logistiques est en 2018 équipé de 75 élévateurs alimentés à l'hydrogène « décarboné » et sa flotte de camion doit être convertie d'ici 2030. Avec un acteur gazier, se prépare un projet d'installation de 12 à 25 MW (extensible) de conversion en hydrogène de l'électricité issue de l'éolien en mer, à échelle industrielle[100],[101],[102].
Au Japon modifier
Fin 2017, le Japon, gros importateur d'énergie, confirme vouloir devenir chef de file en tant que « société hydrogène » avec un objectif de « parité coût » avec l’essence et le GNL pour la production électrique. Comme pour le nucléaire autrefois, l'hydrogène est présenté comme un moyen majeur de décarboner l'énergie, mais les projets pilotes donneront leurs conclusions vers 2020[103],[104]. En 2018, le Japon est en tête pour la mobilité hydrogène, avec près de 2 500 voitures à pile à hydrogène en circulation et plus de cent stations hydrogène (contre 45 en Allemagne, 42 aux États-Unis[105] et une vingtaine en France au même moment)[103],[106]. Le pays vise à diviser par plus de trois le coût de production avant 2030, puis de 80 % avant 2050. Entre 2013 et 2017, l'État japonais a déjà investi 1,5 milliard de dollars dans la R&D et le développement de l’hydrogène[103].
En Californie modifier
En , la Californie compte 7 570 voitures à hydrogène immatriculées[107] et les 42 stations publiques américaines[105].
En Allemagne modifier
Le gouvernement allemand adopte un plan ambitieux de développement de l'hydrogène « vert », doté de 9 milliards d'euros[108].
Moteur à hydrogène modifier
Fusion nucléaire : bombe H et réacteurs à fusion modifier
Dangers, risques et précautions modifier
Le dihydrogène est un gaz classé « extrêmement inflammable ». Il est caractérisé par un domaine d’inflammabilité très large (de 4 à 75 % du volume dans l’air), provoquant une déflagration à partir d’un apport d’énergie d’activation très faible (une étincelle suffit si elle apporte une énergie de 0,02 millijoule (mJ) alors qu’il faut 0,29 mJ pour déclencher une explosion du méthane). Le dihydrogène mélangé à de l'oxygène dans les proportions stœchiométriques est un explosif puissant. Le dihydrogène dans l'air est un mélange détonnant lorsque le rapport volumique H2/air est compris entre 13 et 65 %[109]
L'histoire de son utilisation dans les ballons dirigeables est parsemée d'accidents graves, dont le plus célèbre est la catastrophe du Hindenburg. Le zeppelin LS 129, gonflé de 200 000 m3 de dihydrogène (car les États-Unis avaient déclaré envers l'Allemagne un embargo pour l'hélium) brûla le à son arrivée à l'aérodrome de Lakehurst, près de New York). Trente-six personnes moururent sur le total de 97 embarquées. Les médias présents divulguèrent largement les images de la catastrophe, ce qui conduisit à la désaffection du public pour les ballons. Les enquêtes sur l'origine de l'accident, facilitées par l'abondance de documents photographiques, n'incriminèrent pourtant pas une explosion du dihydrogène, mais une inflammation par contiguïté, à partir d'un incendie de l'enveloppe (causé probablement par une décharge d'électricité statique). La composition du revêtement étanche de l'enveloppe (butyrates et aluminium) aurait favorisé une violente réaction aluminothermique. L'accident aurait toutefois été beaucoup moins violent si le ballon avait été gonflé à l'hélium[50].
Le remplacement du dihydrogène par l'hélium (beaucoup plus coûteux et plus dense) ne produisit pas le regain de faveur attendu. La peur de l'hydrogène resta ; le « syndrome Hindenburg » a probablement injustement pénalisé la filière[50].
Le dihydrogène réagit encore plus violemment avec le dichlore pour former de l'acide chlorhydrique (HCl), même sans activation, et avec le difluor pour former de l'acide fluorhydrique (HF), composés dangereux, même aux températures où l'hydrogène est liquide et le fluor solide, cette dernière réaction étant la réaction chimique la plus exothermique qui soit.
Agressivité à l'égard des matériaux modifier
L'hydrogène corrode de nombreux systèmes d'alliages en les fragilisant[110]. Ceci peut conduire à des défaillances catastrophiques, par exemple de piles à combustible ou de certains processus catalytiques. C'est un problème grave pour les industries qui produisent ou utilisent de l'hydrogène. C'est encore un frein à la production, au transport, au stockage et à un large usage de ce produit[110].
La science des matériaux recherche des matériaux plus résistants à la fragilisation par l'hydrogène, mais ce travail est rendu difficile par la difficulté de mesurer ou d'observer l'hydrogène de manière expérimentale et à l'échelle atomique[110]. Chen et al. ont observé en 2017 la répartition tridimensionnelle précise des atomes d'hydrogène dans un acier ferritique au moyen d'une sonde atomique tomographique fondée sur le deutérium[C'est-à-dire ?], le transfert cryogénique[Quoi ?] et des algorithmes d'analyse de données[111],[110],[112],[113].
Toxicité, écotoxicité modifier
Très peu d'études semblent avoir été menées à ces sujets, probablement parce que les organismes vivants ne sont pas supposés être dans la nature exposés à de l'hydrogène gazeux. En effet, ce gaz étant très léger, il se disperse rapidement vers les très hautes couches de l'atmosphère.
En matière de toxicité pour l'homme, l'hydrogène peut être absorbé dans l’organisme par inhalation. En milieu industriel ou en présence d'une fuite importante, une concentration nocive de ce gaz (sans odeur) dans l'air peut être rapidement atteinte (et former aussi un mélange explosif avec l'air, l'oxygène, les halogènes et tout oxydant puissant, surtout en présence d'un catalyseur métallique comme le nickel ou le platine)[114]. À concentration élevée, l'hydrogène expose à une aggravation de problèmes pulmonaires préexistant et à une anoxie, avec alors des « symptômes tels que maux de tête, bourdonnements dans les oreilles, vertiges, somnolence, perte de conscience, nausée, vomissements et dépression de tous les sens » et une peau pouvant prendre une teinte bleutée, avant asphyxie si l'exposition se prolonge[114].
L'hydrogène n'est pas à ce jour (2019) connu comme étant source de mutagénicité, d'embryotoxicité, de tératogénicité ni de toxicité pour la reproduction[114].
Stockage fixe ou mobile modifier
Les normes de sécurité sont renforcées pour répondre aux risques posés par le passage dans les tunnels et le stationnement dans les garages ou parkings souterrains.
La réglementation mondiale sur les véhicules s’élabore sous l’égide de l'ONU à partir des propositions des industriels, mais en ce qui concerne le dihydrogène, les constructeurs japonais, américains et européens ne s’accordent pas. La Commission européenne pourrait décider d’une réglementation communautaire provisoire.
En France, l’INERIS et le CEA travaillent avec l’Organisation internationale de normalisation (ISO) dans un comité technique nommé TC 197 sur le risque dihydrogène. Un projet européen Hysafe traite aussi de la question, où l’INERIS a critiqué le projet de règlement en suggérant une approche plus globale et systémique et non par composant pour l’homologation des véhicules hybrides. En 2015, le MEDDE a préparé une mise à jour des règlements pour les stations-service et les flottes de véhicules fonctionnant à l'hydrogène[115].
Risque pour la couche d'ozone modifier
Une libération massive du gaz hydrogène a fait évoquer l'hypothèse d'un risque pour la couche d'ozone[116],[117].
Mesures de sûreté modifier
Les points suivants sont notables :
- l'hydrogène n'est pas intrinsèquement toxique ;
- il est huit fois plus léger que le méthane. Sa molécule, très petite, lui confère un haut coefficient de diffusion dans l'air (quatre fois supérieur à celui du méthane) ; en milieu non confiné, l'hydrogène tend donc à monter, et à vite se diluer dans l'air (c'est un facteur de sécurité en plein air, et un facteur de dangerosité dans les lieux confinés) ;
- c'est l'espèce chimique la plus énergétique par unité de masse (120 kJ/g) ; mais par unité de volume de gaz, l'énergie explosive théorique est 3,5 fois plus faible pour l'hydrogène que pour le gaz naturel ;
- sa limite inférieure d'inflammation est de 4 % en volume, comparable à celle du gaz naturel (5 % en volume) ; mais sa limite supérieure d'inflammation est nettement plus élevée (75 % contre 15 %) ; cela signifie qu'en cas de fuite, l'hydrogène s'enflammera beaucoup plus facilement que le gaz naturel ou les combustibles liquides ;
- l'énergie nécessaire pour l'enflammer à la stœchiométrie est également nettement plus faible (environ dix fois) que le gaz naturel ou le propane ;
- la flamme d'hydrogène, bleu pâle, est presque invisible le jour (risque pour les secours) ;
- la flamme d'hydrogène se propage environ sept fois plus vite que celle du gaz naturel et le risque de détonation (explosion avec effet de souffle très important) est aggravé par son haut coefficient de diffusivité.
L'inflammabilité peut en outre être réduite en diluant le dihydrogène dans de l'hélium, même à très haute température[118],[119].
Référence ONU pour le transport de matières dangereuses modifier
- Nom (français) : Hydrogène comprimé
- Classe : 2
- numéro : 1049
- Nom (français) : Hydrogène liquide réfrigéré
- Classe : 2
- numéro : 1966
- Nom (français) : Hydrogène dans un dispositif de stockage à hydrure métallique
- Classe : 2
- numéro : 3468
Notes et références modifier
- HYDROGENE, Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 90e éd., 2804 p. (ISBN 9781420090840, présentation en ligne).
- Jean-Louis Vignes (dir. et Membre de la Société chimique de France) et al., « Dihydrogène : Données Physico-Chimiques », Site de promotion et de pédagogie relatif aux éléments chimiques (du tableau périodique de Dmitri Mendeleïev), sur lelementarium.fr, Paris et Puteaux, Société chimique de France et France Chimie (consulté le ).
- Pierre Ravarini (ingénieur chimiste et hydrologue), « Gaz-Hydrogène », site d'informations scientifiques, techniques et écologiques sur l'eau, Côte de Nacre (Calvados), (consulté le ).
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- « Properties of Various Gases »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur flexwareinc.com (consulté le ).
- Procès-verbaux du Comité international des poids et mesures, 78e session, 1989, p. T1-T21 (et p. T23-T42, version anglaise).
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 14-40.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89.
- Magalie Roy-Auberger, Pierre Marion et Nicolas Boudet, Gazéification du charbon, Éditions techniques de l'ingénieur, réf. J5200, 10 décembre 2009, p. 4.
- « Office of Radiation, Chemical & Biological Safety (ORCBS) » (consulté le ).
- Règlement CE no 1272/2008 [PDF], 16 décembre 2008, sur EUR-Lex, p. 923 : Annexe VI, tableau 3.1, numéro index .
- « Hydrogène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009.
- « hydrogene », sur ESIS, consulté le 15 février 2009
- « La découverte de sources d’hydrogène ouvre la voie à une nouvelle énergie », Le Monde.
- « L’hydrogène naturel, un eldorado énergétique ? », Sciences et Avenir.
- « Un « élan croissant » pour la production d'hydrogène bas carbone mais... », sur Connaissances des énergies, (consulté le ).
- Expériences de lavoisier, sur lavoisier.cnrs.fr.
- Rendement de la chaîne hydrogène (fiche technique), Ademe, (lire en ligne [PDF]).
- « Détecter les émanations naturelles d’hydrogène grâce aux images satellites - Lancement du projet sen4H2 », sur IFP Énergies nouvelles (consulté le ).
- Prinzhofer et Deville 2015.
- Isabelle Moretti, « L'hydrogène naturel : curiosité géologique ou source d'énergie majeure dans le futur ? », sur Connaissance des énergies, .
- « Ressources minérales grand fond », sur Ifremer (consulté le ). L'article présente une carte des fonds marins donnant la distribution connue en serpentine le long des dorsales..
- Sylvestre Huet, « L'hydrogène natif, une nouvelle source d'énergie ? », sur sciences.blogs.liberation.fr, Libération, (consulté le ).
- « Réaction eau de mer-manteau : formation de la serpentine », sur Ifremer (consulté le ).
- « Synthèse d'hydrogène, de méthane et d’hydrocarbures dans les grands fonds, vers de nouvelles ressources énergétiques… », sur Ifremer (consulté le ).
- « De l'hydrogène, oui, mais de l'hydrogène naturel », sur La Tribune, (consulté le ).
- L'hydrogène naturel : une contribution au mix énergétique ?, IFP Énergies nouvelles, .
- Julia Guélard, Caractérisation des émanations de dihydrogène naturel en contexte intracratonique : exemple d'une interaction gaz/eau/roche au Kansas (thèse de doctorat en géochimie), Université Pierre-et-Marie-Curie et IFP Énergies nouvelles, (présentation en ligne, lire en ligne).
- (en) J. Guélard, V. Beaumont, V. Rouchon et F. Guyot, « Natural H2 in Kansas: Deep or shallow origin? », Geochemistry, Geophysics, Geosystems, vol. 18, no 5, , p. 1841–1865 (ISSN 1525-2027, DOI 10.1002/2016GC006544, résumé, lire en ligne, consulté le ).
- J. Guélard et al., « Natural H 2 in Kansas: Deep or shallow origin? », Geochemistry Geophysics Geosystems, (DOI 10.1002/2016GC006544, présentation en ligne, lire en ligne [PDF], consulté le ).
- (en) Alain Prinzhofer, Isabelle Moretti, Joao Françolin et Cleuton Pacheco, « Natural hydrogen continuous emission from sedimentary basins: The example of a Brazilian H2-emitting structure », International Journal of Hydrogen Energy, vol. 44, no 12, , p. 5676–5685 (DOI 10.1016/j.ijhydene.2019.01.119, lire en ligne, consulté le ).
- (en) Isabelle Moretti, Emyrose Brouilly, Keanu Loiseau, Alain Prinzhofer et Éric Deville, « Hydrogen Emanations in Intracratonic Areas: New Guide Lines for Early Exploration Basin Screening », Geosciences, MDPI, vol. 11, no 3, (DOI 10.3390/geosciences11030145, lire en ligne, consulté le ).
- (en) Maria Rosanne, Fabian Rupin, Louis Gorintin, Julio Aguilar, Hélène Buee, Julien Werly, Olivier Lhote et Xi Yao, « Parhys system: a new approach to H2 concentration measurements in the subsurface », H-nat summit, 2-, (lire en ligne, consulté le ).
- Barbara Sherwood Lollar, T. C. Onstott, G. Lacrampe-Couloume et C. J. Ballentine, « The contribution of the Precambrian continental lithosphere to global H2 production », Nature, vol. 516, no 7531, , p. 379–382 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/nature14017).
- (en) H. Hosgormez, G. Etiope et M. N. Yalçin, « New evidence for a mixed inorganic and organic origin of the Olympic Chimaera fire (Turkey): a large onshore seepage of abiogenic gas », Geofluids, vol. 8, no 4, , p. 263–273 (DOI 10.1111/j.1468-8123.2008.00226.x).
- « Bourakébougou : la promesse d'une centrale électrique à hydrogène », (consulté le ).
- Alain Prinzhofer, Cheick Sidy Tahara Cissé et Aliou Boubacar Diallo, « Discovery of a large accumulation of natural hydrogen in Bourakebougou (Mali) », International Journal of Hydrogen Energy, vol. 43, no 42, , p. 19315–19326 (ISSN 0360-3199, DOI 10.1016/j.ijhydene.2018.08.193).
- « L'hydrogène selon Isabelle Moretti », Sciences et Avenir (consulté le ).
- Isabelle Moretti, Alain Prinzhofer, João Françolin et Cleuton Pacheco, « Long-term monitoring of natural hydrogen superficial emissions in a brazilian cratonic environment. Sporadic large pulses versus daily periodic emissions », International Journal of Hydrogen Energy, vol. 46, no 5, , p. 3615–3628 (ISSN 0360-3199, DOI 10.1016/j.ijhydene.2020.11.026).
- (en) Emanuelle Frery, Laurent Langhi, Mederic Maison et Isabelle Moretti, « Natural hydrogen seeps identified in the North Perth Basin, Western Australia », International Journal of Hydrogen Energy, , S0360319921026045 (DOI 10.1016/j.ijhydene.2021.07.023, lire en ligne, consulté le ).
- (en) Christopher J. Boreham, Dianne S. Edwards, Krystian Czado et Nadege Rollet, « Hydrogen in Australian natural gas: occurrences, sources and resources », The APPEA Journal, vol. 61, no 1, , p. 163–191 (ISSN 2206-8996, DOI 10.1071/AJ20044, lire en ligne, consulté le ).
- « L'hydrogène naturel une source beaucoup plus importante qu'on ne le pensait selon le CNRS », sur erh2-bretagne.mystrikingly.com, (consulté le ).
- (en) Eric C. Gaucher, « New Perspectives in the Industrial Exploration for Native Hydrogen », Elements, vol. 16, no 1, , p. 8–9 (ISSN 1811-5217 et 1811-5209, DOI 10.2138/gselements.16.1.8, lire en ligne, consulté le ).
- (en) Éric C. Gaucher, Isabelle Moretti, Nicolas Pélissier, Glen Burridge et Nicolas Gonthier, « The place of natural hydrogen in the energy transition: A position paper. », European Geologist Journal, no 55, (lire en ligne , consulté le ).
- « Le 15 avril 1988, le Tu-155 vole à l’hydrogène », sur Aerobuzz, (consulté le ).
- (en) Julien Mouli-Castillo, Sam Bartlett, Arul Murugan, Pete Badham, Aidan Wrynne, Stuart Haszeldine, Mark Wheeldon et Angus McIntosh, « Olfactory appraisal of odorants for 100% hydrogen networks », International Journal of Hydrogen Energy, Elsevier BV, vol. 45, no 20, , p. 11875-11884 (ISSN 0360-3199, DOI 10.1016/j.ijhydene.2020.02.095).
- L'hydrogène, les nouvelles technologies de l'énergie. Les clefs CEA, no 50/51, Hiver 2004-2005 (ISSN 0298-6248).
- Rapport du projet européen StorHy, p. 8, hydrogen loss rate.
- Article de la Tribune L'Europe finance une batterie géante pour stocker l'énergie renouvelable.
- (en) T. Mitsui, M. K. Rose, E. Fomin, D. F. Ogletree et M. Salmeron, « Dissociative hydrogen adsorption on palladium requires aggregates of three or more vacancies », Nature, vol. 422, , p. 705-707 (DOI 10.1038/nature01557, lire en ligne [PDF]).
- (en) The Future of Hydrogen - Seizing today’s opportunities [PDF], Agence internationale de l'énergie, juin 2019.
- « Fin du gaz russe : l’hydrogène et l’ammoniac bleu comme alternative de luxe ? », sur France 24, (consulté le ).
- (en) Gas Decarbonisation Pathways 2020–2050, Gas for climate, , 226 p. (lire en ligne [PDF]), p. 17-18.
- Laurent Fulcheri, « « L’hydrogène turquoise », une solution viable sans CO2 ? », Polytechnique Insights, Institut polytechnique de Paris, (consulté le ).
- L'hydrogène pourra-t-il verdir le transport lourd?, lesaffaires.com, .
- « Hydrogène vert », sur Gouvernement du Québec (consulté le ).
- « Plan de relance : quelle place pour l’énergie ? », sur connaissancedesenergies.org, .
- « Les 7 couleurs de l’hydrogène », sur H2H24 (consulté le ).
- Olivier Daelen, « Cette centrale nucléaire britannique veut produire de l’hydrogène rose : une première en Europe », sur fr.businessam.be, 2 août 2021.
- « Le plan hydrogène français entérine discrètement la relance du nucléaire », sur Reporterre, .
- (en) « Hydrogen produced from nuclear will be considered ‘low-carbon’, EU official says » [« L'hydrogène produit à partir du nucléaire sera considéré comme « à faible empreinte en carbone », selon un fonctionnaire de l'UE »], sur EURACTIV, .
- (en-US) admin, « Colors », sur Hydrogen x Revolve (consulté le ).
- (en) « L’hydrogène et ses 50 nuances de gris, vert, bleu… », sur Energy Cities, (consulté le ).
- Official CertifHy definitions (CertifHy 2016) Green and Blue Hydrogen, sur certifhy.ca (consulté le 19 janvier 2022).
- « Une nouvelle technologie de pyrolyse plasma du méthane pour produire de l'hydrogène », sur Éditions techniques de l'ingénieur, (consulté le ).
- (en) Florian Osselin, Cyprien Soulaine, C. Fauguerolles, Éric C. Gaucher, Bruno Scaillet et al., « Orange hydrogen is the new green », Nature Geoscience, vol. 15, no 10, , p. 765-769 (DOI 10.1038/s41561-022-01043-9, lire en ligne [PDF], consulté le ).
- « Et si l'hydrogène naturel était le game changer de la transition énergétique ? », sur La Tribune (consulté le ).
- « La France a une carte à jouer dans l'hydrogène naturel », sur h2-mobile.fr (consulté le ).
- « Changement climatique: un plan pour l'hydrogène renouvelable et l'intégration des systèmes énergétiques », Parlement européen, 19 mai 2021.
- « L'hydrogène vert, chaînon manquant de la transition », Alternatives économiques (consulté le ).
- Interactions [PDF] (lettre aux actionnaires), Air liquide, septembre 2015, p. 5.
- (en) Liz Gyekye, « Australia backs tech that converts biogas into hydrogen and graphite », Biomarketing sights, 4 septembre 2019.
- Jérôme Marin, « Lhyfe va produire de l'hydrogène vert avec des éoliennes », La Tribune, .
- (en) Agence internationale de l'énergie, « Global Hydrogen Review 2022 », (consulté le ).
- « L'Ademe liste les « contributions majeures » de l'hydrogène à la transition énergétique », Connaissance des énergies, 4 avril 2018.
- Aline Nippert, « Les fuites d’hydrogène réchauffent le climat », sur Reporterre, .
- « Bénéfice climatique d'une future économie de l'hydrogène », sur insu.cnrs.fr, .
- Nikolaus J. Kurmayer, « Les scientifiques mettent en garde contre l’effet des fuites d’hydrogène sur le réchauffement climatique », sur EURACTIV, .
- Bernard Deboyser, « Des scientifiques alertent : les fuites d’hydrogène sont 200 fois plus néfastes pour le climat que le CO2 », sur revolution-energetique.com, .
- Aline Nippert, « « L’hydrogène n’est pas neutre pour le climat, mais l’économie hydrogène reste très bénéfique pour limiter le réchauffement climatique », assure le climatologue Didier Hauglustaine », L'Usine nouvelle, .
- (en) Didier Hauglustaine, Fabien Paulot, William Collins, Richard Derwent, Maria Sand et Olivier Boucher, « Climate benefit of a future hydrogen economy », Communications Earth & Environment, no 295, (lire en ligne).
- Le vecteur hydrogène dans la transition énergétique [PDF], Avis de l'ADEME, avril 2018.
- Séverine Fontaine, « L’Ademe veut de l’hydrogène à partir d’énergies renouvelable », L’Automobile & L’Entreprise, no 5, (lire en ligne).
- Le plan de Bruxelles pour faire « décoller » l'hydrogène en Europe, CCFA, 9 juillet 2020.
- Le plan de Bruxelles pour faire « décoller » l'hydrogène en Europe, Les Échos, 9 juillet 2020.
- « Plan hydrogène : l’Europe vise une production de masse et décarbonée dès 2030 », L'Usine nouvelle, (lire en ligne, consulté le ).
- L’hydrogène dans la transition énergétique [PDF], Ademe, février 2016, 7 p.
- « Des chercheurs grenoblois optimisent la photosynthèse artificielle pour produire de l’hydrogène », sur placegrenet.fr, (consulté le ).
- Véronique Pouzard, « L'électrolyse à haute température du CEA portée par la start-up Sylfen »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), Les Échos, (consulté le ).
- AFP (2019), Hydrogène « vert » : coopération entre Air liquide, Engie et l'agglomération Durance, Lubéron, Verdon, 13 novembre 2019.
- McPhy au centre de la plus grande unité de production d'hydrogène zéro-carbone en Europe, Les Échos, 22 janvier 2020.
- Plan de relance : la France change d'échelle dans l'hydrogène, Les Échos, 3 septembre 2020.
- Hydrogène : la France détaille son plan à 7 milliards d'euros, Les Échos, 8 septembre 2020.
- Hydrogène : le gouvernement veut créer un « Airbus de l'électrolyse », Les Échos, 8 septembre 2020.
- (en) « KU Leuven scientists crack the code for affordable, eco-friendly hydrogen gas », sur KU Leuven (consulté le ).
- « Des chercheurs belges développent un panneau solaire qui produit de l'hydrogène », sur RTBF Info, (consulté le ).
- « Groupe Colruyt: le pari de la mobilité à l'hydrogène », sur RTBF Info, (consulté le ).
- « Colruyt et Fluxys veulent construire une usine d’hydrogène, une première en Belgique », Le Soir, (consulté le ).
- « Conduire à l’hydrogène : notre expérience », Le Moniteur automobile (consulté le ).
- (en) Monica Nagashima (Institute of Energy Economics, Japon), Japan's hydrogen strategy and its economic and geopolitical implications [PDF], Institut français des relations internationales, octobre 2018.
- « La « stratégie hydrogène » du Japon », Connaissance des énergies, 9 octobre 2018.
- (en) « Alternative Fuels Data Center: Hydrogen Fueling Station Locations », sur Alternative Fuels Data Center, Département de l'Énergie des États-Unis (consulté le ).
- Benoît Le Floc'h, « Quid de l’hydrogène pour les véhicules utilitaires légers ? », sur Caradisiac, (consulté le ).
- « La Californie passe le cap des 7500 voitures hydrogène en circulation », sur h2-mobile.fr (consulté le ).
- (en) « German government adopts hydrogen strategy » [« Le gouvernement allemand adopte une stratégie sur l'hydrogène »], sur Gouvernement fédéral (Allemagne), .
- Accidentologie de l’hydrogène, ministère de l’Écologie, de l’Énergie, du Développement durable et Aménagement du territoire, 18 p. (lire en ligne [PDF]), p. 4.
- Julie Cairney, « Atoms on the move—finding the hydrogen »', Science, 17 mars 2017, vol. 355, no 6330, p. 1128-1129, DOI 10.1126/science.aam8616 (résumé).
- (en) Y.-S. Chen, D. Haley, S. S. A. Gerstl, A. J. London, F. Sweeney, R. A. Wepf, W. M. Rainforth, P. A. J. Bagot et M. P. Moody, « Direct observation of individual hydrogen atoms at trapping sites in a ferritic steel », Science, vol. 355, no 6330, , p. 1196–1199 (ISSN 0036-8075, PMID 28302855, DOI 10.1126/science.aal2418).
- Yi-Sheng Chen, Paul A.J. Bagot, Michael P. Moody et Daniel Haley, « Observing hydrogen in steel using cryogenic atom probe tomography: A simplified approach », International Journal of Hydrogen Energy, vol. 44, no 60, , p. 32280–32291 (ISSN 0360-3199, DOI 10.1016/j.ijhydene.2019.09.232).
- Yi-Sheng Chen, Matthew J. Griffith et Julie M. Cairney, « Cryo Atom Probe: Freezing atoms in place for 3D mapping », Nano Today, vol. 37, , p. 101107 (ISSN 1748-0132, DOI 10.1016/j.nantod.2021.101107).
- « Hydrogen - H ; Chemical properties of hydrogen - Health effects of hydrogen - Environmental effects of hydrogen », Lenntech (consulté le 11 janvier 2019)
- Radisson, Laurent (2015), Risques hydrogène : le ministère de l'Écologie travaille sur de nouveaux textes, sur actu-environnement.com, 21 octobre 2015.
- (en) T. Rahn, J. M. Eiler, K. A. Boering, P. O. Wennberg, M. C. McCarthy, S. Tyler, S. Schauffler, S. Donelly et E. Atlas, Extreme deuterium enrichment in stratospheric hydrogen and the global atmospheric budget of H2, Nature, 424, 2003, p. 918-921.
- (en) T. K. Tromp, R-L Shia, M. Allen, J. M. Eiler et Y. L. Yung, « Potential environmental impact of a hydrogen economy on the stratosphere », Science, no 300, , p. 1740-1742 (DOI 10.1126/science.1085169).
- Céline Duguey, « Une expérience explosive », sur Espace des sciences, (consulté le ).
- (en) Florent Tonus, Mona Bahout, Paul F. Henry et Siân E. Dutton, « Use of in situneutron diffraction to monitor high-temperature, solid/H2-gas reactions », Chemical Communications, no 18, , p. 2556–2558 (ISSN 1364-548X, PMID 19532888, DOI 10.1039/B822419F, lire en ligne, consulté le ).
Voir aussi modifier
Bibliographie modifier
- Camille Yver, Quantifier l'utilisation du dihydrogène par les sols : de l'échelle locale à l'échelle globale, 2011, DOI 10.4267/2042/47372 (résumé — Prix Prud'homme 2011.
- Stephen Boucher, Thierry Alleau (préface), La Révolution de l'hydrogène. Vers une énergie propre et performante ?, Paris, Éd. du Felin, 2006, 160 p. (ISBN 2-86645-616-5).
- Alain Prinzhofer et Éric Deville, Hydrogène naturel - La prochaine révolution énergétique ?, Belin, (ISBN 978-27011-83848).
Articles connexes modifier
- Hydrogène
- Biogaz
- Deutérure d'hydrogène
- Dideutérium
- Conversion d'électricité en gaz
- Vecteur énergétique
Liens externes modifier
- Association française de l'hydrogène
- Réseau européen/Pôle de compétence
- « H2 Sciences et Techniques »
- CEA Technologies, L'hydrogène, les nouvelles technologies de l'énergie, Clefs CEA no 50-51), 23 mars 2005
- L'hydrogène vu par le CEA
- INERIS : retour d'expérience lié aux difficultés de stockage
- L'hydrogène vu par la Société française de chimie
- Tout sur l'Alternative Hydrogène, avec une revue de presse, des liens internet et des vidéos