Caranx rhonchus
Caranx ronfleur
Caranx rhonchus est une espèce de poisson marin de taille moyenne classée dans la famille des carangidés. Elle est répartie dans les eaux tropicales et tempérées de l'océan Atlantique oriental, de la Namibie au sud à l'Espagne et dans la majeure partie de la Méditerranée.
Description
modifierL'espèce a une forme corporelle atypique par rapport aux autres espèces du genre Caranx, et peut être distinguée de ces dernières par sa forme allongée. Il est plus difficile de distinguer l'espèce des membres des genres Decapterus et Trachurus, ce qui nécessite une analyse anatomique détaillée. Elle peut atteindre une longueur de 60 cm et un poids de 1 kg.
Répartition
modifierCe taxon se rencontre dans les pays suivants[1] : Algérie, Angola, Bénin, Cameroun, Chypre, Côte d'Ivoire, Espagne, France, Gabon, Gambie, Ghana, Gibraltar, Grèce, Guinée équatoriale, Guinée-Bissau, Guinée, Israël, Italie, Liban, Liberia, Libye, Malte, Maroc, Mauritanie, Nigeria, Portugal, République arabe sahraouie démocratique, République du Congo, République démocratique du Congo, Sao Tomé-et-Principe, Sierra Leone, Syrie, Sénégal, Togo, Tunisie, Turquie, Égypte.
Les larves de cette espèce ont été recensées pour la première fois au nord-ouest de la Méditerranée au début des années 2000, montrant que cette espèce d'origine Atlantique s'implante en Méditerranée[2] où différentes études ont mis en évidence l'augmentation de son abondance dans différentes zones[3],[4],[5],[6]. L’arrivée ou l'accroissement des populations, en plus des poissons lessepsiens, d’espèces atlantiques ayant des affinités pour les eaux chaudes, comme C. rhonchus, accentue le caractère subtropical de l'ichtyofaune Méditerranéenne[7]. Il a par ailleurs été montré que Caranx rhonchus (ainsi que Diplodus cervinus cervinus et Xyrichtys novacula) n'a été capturé que sporadiquement au cours de la seconde moitié du XXe siècle dans le nord de la mer de Catalogne alors que dans les années 2010 elle était capable de s'y reproduire, suggérant une "méridionalisation" de cette dernière[8].
Habitat
modifierL'espèce est considérée comme benthopélagique, pouvant être associée aux dispositifs d'agrégation des poissons utilisés pour la pêche[9]. Elle vit à la fois dans les eaux pélagiques et démersales du plateau continental, à des profondeurs allant de 15 à 200 m. Ce poisson préfère les eaux salées, claires, de température relativement froide. Les jeunes vivent à la côte, les adultes sur tout le plateau continental, ces derniers effectuant des déplacements importants le long des côtes d'Afrique de l'Ouest[10].
L'espèce est classée parmi les espèces « Marines occasionnelles »[a] (Mo) dans la classification d'Albaret[11] pour les poissons des milieux estuariens et lagunaires d'Afrique de l'Ouest[12] et « Marine immigrant »[b] dans celle de Whitfield[13].
Biologie
modifierIl a été mis en évidence[14] une association entre juvéniles de C. rhonchus (entre 11,9 et 43 mm de LS[c]) et les méduses Rhizostoma pulmo et Cotylorhiza tuberculata. Cette étude fournit la première preuve de l'association entre l'espèce thermophile C. rhonchus et les méduses au nord-ouest de la Méditerranée . L'hypothèse qui sous-tend cette association met en avant le rôle des méduses dans la protection et l'approvisionnement en nourriture pour les jeunes poissons, et en tant que "point de rencontre" pour les individus. Cette association favoriserait la survie des premiers stades de vie des poissons, augmentant ainsi leur recrutement ultérieur. Dans le cas des carangidés, l'augmentation des proliférations de méduses en Méditerranée, ainsi que d'objets flottants, pourrait également avoir contribué à leur expansion vers le nord, fournissant des conditions adéquates pour le recrutement et la survie des jeunes poissons[14].
Reproduction
modifierElle atteint la maturité sexuelle à l'âge de 2 ans, le frai ayant lieu entre avril et juillet dans les eaux côtières peu profondes, où restent les juvéniles. Les œufs et larves peuvent cependant être en partie emportées vers le large par les courants, comme au large de la Mauritanie où elles ont été relevées parmi les espèces dominantes dans l'ichtyoplancton lors de la saison chaude (juin à novembre)[15].
Dans le Golfe de Gabès, C. rhonchus atteint sa maturité sexuelle autour de 18 cm (LT 50%[d] femelles = 182,09 mm et LT 50% mâles = 182,2 mm). Les cycles sexuels synchrones pour les mâles et les femelles et la période de reproduction s’étend de mars à novembre et la ponte a lieu en octobre-novembre. La maturation gonadique coïncide avec l’augmentation de la température dans le golfe de Gabès, et la ponte a lieu lors de la baisse de la température[16].
Le long des côtes sénégalaises, la reproduction a lieu d'avril à juillet dans les années 70[17]. Il a été indiqué à cette période qu'il pourrait exister une seconde poussée reproductive beaucoup moins importante en novembre-décembre (Overko, 1971). Les larves étaient présentes en abondance (jusqu'à 90% des larves de carangidés récoltées d'avril à novembre (avec un maximum très net en mai-juin) entre 1968 et 1969[18].
Alimentation
modifierIl s'agit d'un poisson prédateur, principalement piscivore mais dont le régime alimentaire se caractérise par une large gamme d'espèces. Leurs proies principales sont des petits poissons, des crustacés, dont les euphausiacés, les crevettes, et les céphalopodes, avec d'importants changements de régime alimentaire au fur et à mesure que l'espèce vieillit. Dans le Golfe de Gabès en Méditerranée centrale, l'anchois Engraulis encrasicolus était l'espèce de téléostéen la plus importante, tandis que les crustacés étaient la deuxième catégorie d'aliments la plus consommée[19].
Un étude réalisée au milieu des années 1970 dans la région du Cap Blanc en Mauritanie[20] a montré que les principales proies de cette espèce étaient : 1. des Euphausiacés, 2. des Mysidacés, 3. des Isopodes, 4. des larves de Malacostracés (megalopae), 5. des larves et des juvéniles de poissons, 6. des poissons (dont Maurolicus muelleri, et des Carangidés), 7. Branchiostoma lanceolatum, et 8. des Tuniciers. Dans la même zone, en 2016, les proies principales étaient les bivalves (Tellina sp.), les larves de Mysidacés et surtout les poissons Engraulis encrasicolus et Trachurus trecae (et Sardinella sp. dans une moindre proportion)[21].
Pêche
modifierL'espèce est d'une importance majeure pour les pêcheries dans toute son aire de répartition, mais n'a représenté que 0,94 % des prises de petits poissons pélagiques dans la région Nord-Ouest africaine en 2020[22].
En 2011, une campagne d'estimation des ressources halieutiques (démersales et pélagiques) de la ZEE de Guinée-Bissau, effectuée par le navire de recherche Al-Awam du 18 au 25 octobre a permis d'estimer la biomasse totale des petits pélagiques à 452 000 tonnes dont 39 000 tonnes pour Caranx rhonchus[23], alors que celle réalisée en 2013 par le navire Atlandida, a estimé que la biomasse des petits pélagiques était de 340 000 tonnes, dont seulement 19 000 tonnes (6%) pour C. rhonchus[23].
D'après le rapport du groupe de travail sur l’évaluation des petits pélagiques au large de l’Afrique nord-occidentale, qui s'est tenu en juin 2021[24], les captures de Caranx rhonchus ont augmenté de manière significative (94 %), passant de 12 000 tonnes en 2019 à 24 000 tonnes en 2020. D'après ce rapport, les niveaux de capture de 2020 correspondraient à la moyenne à long terme de l'espèce (24 000 tonnes de 1990 à 2020), et la moyenne quinquennale de l'espèce serait d'environ 15 000 tonnes. Cependant ces données semblent élevées par rapport aux données globales de la FAO indiquées dans la figure d'évolution des captures et dans le paragraphe ci-dessous.
Globalement, l'évolution des captures de l'espèce entre 1950 et 2021 d'après la FAO[25] présente une remontée en 2020-2021 (7585-12391 t.), après une baisse en 2019 (5931 t.) (voir figure). Il faut cependant noter que la collecte et le traitement des statistiques des années 2019-2020 peuvent avoir été fortement bouleversés par la pandémie de COVID-19[26],[27]. Mais la figure montre un autre creux de captures en 2016 (3003 t.).
L'espèce est capturée à l'aide de chaluts, de sennes et de filets maillants et vendue fraîche, congelée ou salée.
Protection
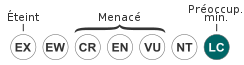
modifierC'est une espèce commune, qui a été évaluée pour la Liste rouge de l'UICN des espèces menacées en 2011[28] en Méditerranée et globalement en 2013[29]. L'espèce était alors classée dans la catégorie "Préoccupation mineure" et la révision de 2016 en Atlantique centre-est a maintenu ce classement[30]. En 2023 aucune mesure de conservation n'est mise en place pour cette espèce[29]. Cette espèce a été trouvée dans plusieurs aires marines protégées[29].
Systématique
modifierLe nom valide complet (avec auteur) de ce taxon est Caranx rhonchus Geoffroy Saint-Hilaire, 1817[31].
Ce taxon porte en français les noms vernaculaires ou normalisés suivants : Carangue Jaune[1], Chinchard[1], Chinchard Jaune[1], Comète Coussut[1], Saurel[1].
Caranx rhonchus a pour synonymes[31] :
- Caranx angolensis Fowler, 1919
- Caranx rhoncus Geoffroy Saint-Hilaire, 1817
- Caranx ronchus Geoffroy Saint-Hilaire, 1817
- Decapterus angolensis (Fowler, 1919)
- Decapterus rhonchus (Geoffroy Saint-Hilaire, 1817)
- Decapterus ronchus (Geoffroy Saint-Hilaire, 1817)
Publication originale
modifier- Geoffroy St. Hilaire, E. (1817). Poissons du Nil, de la mer Rouge et de la Méditerranée. In: Description de l'Égypte ou recueil des observations et des recherches qui ont été faites en Égypte pendant l'expedition de l'Armée française, publié par les ordres de sa Majesté-L'Empereur Napoléon le Grand. (Imprimerie Impériale). Paris. Histoire Naturelle. v. 1 (part 1). Pls. 18-27[lire en ligne].
Étymologie
modifierCaranx : Lacepède dit qu'il est dérivé de kara, tête, « à cause de l'espèce de proéminence que leur tête présente, de la force de cette partie, de l'éclat avec lequel elle brille, et, de plus, pour annoncer l'espèce de puissance et de domination que beaucoup d'arêtes de cette espèce exercent sur beaucoup de poissons qui fréquentent les rivages », tandis que Jordan & Evermann[32] affirment que ce nom vient du français carangue (utilisé pour des poissons apparentés dans les Caraïbes), une corruption d'acarauna en portugais[33].
Rhonchus : Ronfleur ou croqueur, de chakhoura (= ronfleur), nom arabe de cette espèce le long de la Méditerranée en Égypte, allusion non expliquée, peut-être au bruit qu'elle fait lorsqu'elle est tirée de l'eau[33].
Liens externes
modifier- (en) ECoF, « Caranx rhonchus », sur Eschmeyer's Catalog of Fishes, California Academy of Science, (consulté le )
- (en) Myers, P. et al., Animal Diversity Web : Caranx rhonchus, 2023 (consulté le )
- (en) Référence Catalogue of Life : Caranx rhonchus Geoffroy Saint-Hilaire, 1817 (consulté le )
- (fr + en) Référence EOL : Caranx rhonchus Geoffroy Saint-Hilaire 1817 (consulté le )
- (en + fr) Référence FishBase : (consulté le )
- (fr + en) Référence GBIF : Caranx rhonchus Geoffroy Saint-Hilaire, 1817 (consulté le )
- (fr) Référence INPN : Caranx rhonchus Geoffroy Saint-Hilaire, 1817 (TAXREF) (consulté le )
- (en) Référence IRMNG : Caranx rhonchus Geoffroy Saint-Hilaire, 1817 (consulté le )
- (fr + en) Référence ITIS : Caranx rhonchus Geoffroy Saint-Hilaire, 1817 (consulté le )
- (en) Référence NCBI : Caranx rhonchus (taxons inclus) (consulté le )
- (en) Référence Taxonomicon : Caranx rhonchus Geoffroy Saint-Hilaire, 1817 (consulté le )
- (en) Référence UICN : espèce Caranx rhonchus Geoffroy Saint-Hilaire, 1817 (consulté le )
- (en) Référence WoRMS : espèce Caranx rhonchus Geoffroy Saint-Hilaire, 1817 (consulté le )
Notes et références
modifierNotes
modifier- Espèces rares voire exceptionnelles dans les milieux estuariens et lagunaires. Elles sont localisées généralement prés des endroits où il y a une communication avec la mer. Elles ne se reproduisent pas en milieux estuariens et lagunaires, et leur euryhalinité est faible.
- Espèces de poissons marins qui se reproduisent généralement en mer et dont les juvéniles et/ou les adultes utilisent largement l'environnement estuarien. Les juvéniles d'un grand nombre de ces espèces sont plus ou moins dépendants des estuaires en tant que zones d'alevinage.
- Longueur standard
- La taille à première maturité (Lm50) est la longueur à laquelle 50 % des poissons ont atteint la maturité.
Références
modifier- UICN, consulté le 18 décembre 2023
- (en) Raya, V., Sabatés, A., « Diversity and distribution of early life stages of carangid fishes in the northwestern Mediterranean: responses to environmental drivers », Fisheries Oceanography, vol. 24, no 2, , p. 118‑134 (ISSN 1365-2419, DOI 10.1111/fog.12097)
- Coco, S., Roncarati, A., Tiralongo, F., Felici, A., « Meridionalization as a Possible Resource for Fisheries: The Case Study of Caranx rhonchus Geoffroy Saint-Hilaire, 1817, in Southern Italian Waters », Journal of Marine Science and Engineering, Multidisciplinary Digital Publishing Institute, vol. 10, no 2, , p. 274 (ISSN 2077-1312, DOI 10.3390/jmse10020274)
- Pecarevic, M., Mikus, J., Cetinic, A. B., Dulcic, J., Calic, M., « Introduced marine species in Croatian waters (Eastern Adriatic Sea) », Mediterranean Marine Science, vol. 14, no 1, , p. 224‑237 (ISSN 1791-6763, DOI 10.12681/mms.383)
- Sley, A., Hadj Taeib, A., Jarboui, O., Ghorbel, M., Bouain, A., « Annual reproductive cycle, spawning periodicity and sexual maturity of false scad Caranx rhonchus (Geoffroy Saint-Hilaire, 1817) (Pisces, Carangidae) from the South-Eastern Mediterranean (Gulf of Gabès, Tunisia) », Journal of Applied Ichthyology, vol. 31, no 3, , p. 437‑441 (ISSN 1439-0426, DOI 10.1111/jai.12675)
- Tiralongo, F., Crocetta, F., Riginella, E., Lillo, A. O., Tondo, E., Macali, A., Mancini, E., Russo, F., Coco, S., Paolillo, G., Azzurro, E., « Snapshot of rare, exotic and overlooked fish species in the Italian seas: A citizen science survey », Journal of Sea Research, vol. 164, , p. 101930 (ISSN 1385-1101, DOI 10.1016/j.seares.2020.101930)
- Bradai, M. N., Quignard, J. P., Bouain, A., Jarboui, O., Ouannes-Ghorbel, A., Ben Abdallah, L., Zaouali, J., Ben Salem, S., « Ichtyofaune autochtone et exotique des côtes tunisiennes: recensement et biogéographie », Cybium, vol. 28, no 4, , p. 315‑328 (lire en ligne)
- (en) Lloret, J., Sabatés, A., Muñoz, M., Demestre, M., Solé, I., Font, T., Casadevall, M., Martín, P., Gómez, S., « How a multidisciplinary approach involving ethnoecology, biology and fisheries can help explain the spatio-temporal changes in marine fish abundance resulting from climate change », Global Ecology and Biogeography, vol. 24, no 4, , p. 448‑461 (ISSN 1466-8238, DOI 10.1111/geb.12276, lire en ligne )
- Castro, J. J., Santiago, J. A., Santana-Ortega, A. T., « A general theory on fish aggregation to floating objects: An alternative to the meeting point hypothesis », Reviews in Fish Biology and Fisheries, vol. 11, no 3, , p. 255‑277 (DOI 10.1023/A:1020302414472)
- Berrit, G. R., Rebert, J.-P., Boëly, T., Marchal, E., Domain, F., & Pianet, R., Le milieu marin de la Guinée Bissau et ses ressources vivantes : le point des connaissances, Paris, ORSTOM, , 154 p. (lire en ligne), p. 68
- Albaret, J. J., Les peuplements des estuaires et des lagunes, Paris, IRD Editions, , 512 p. (ISBN 978-2-7099-2042-1, lire en ligne), « Les poissons des eaux continentales africaines: diversité, écologie, utilisation par l’homme », p. 325‑349
- Albaret, J. J., Simier, M., Sadio, O., Suivi biologique des peuplements de poissons d’une aire protégée en zone de mangrove : le bolon de Bamboung (Sine Saloum, Sénégal) - Rapport final 2005, Dakar, Sénégal, IRD Dakar, , 80 p. (lire en ligne), p. 21
- (en) Whitfield, A. K., « Preliminary documentation and assessment of fish diversity in sub-Saharan African estuaries », African Journal of Marine Science, vol. 27, no 1, , p. 307‑324 (lire en ligne )
- (en) Tilves, U., Sabatés, A., Blázquez, M., Raya, V., Fuentes, V. L., « Associations between fish and jellyfish in the NW Mediterranean », Marine Biology, vol. 165, no 8, , p. 165-127 (ISSN 1432-1793, DOI 10.1007/s00227-018-3381-4, lire en ligne )
- Arkhipov, A., « Seasonal and interannual variation of ichthyoplankton off Mauritania », Journal of Ichthyology, vol. 49, no 6, , p. 460‑468 (DOI 10.1134/S0032945209060058)
- Sley, A., Jarboui, O., Bouain, A., « Étude comparative entre les paramètres de reproduction de deux espèces de carangidae : Caranx crysos et Caranx rhonchus du golfe de Gabès », INSTM Bulletin : Marine and Freshwater Sciences, vol. 40, , p. 15‑25 (ISSN 2811-6534, lire en ligne )
- Boëly, T., Wysokinski, A., Elwertowski, J., Les chinchards des côtes sénégalaises et mauritaniennes : biologie – déplacements – ressources, Paris, ORSTOM, , 49 p. (lire en ligne), p. 22
- Conand, F., Franqueville, C., « Identification et distribution saisonnière de larves de Carangides au large du Sénégal et de la Gambie », Bulletin de l’IFAN, vol. 35, no 4, , p. 951‑978
- (en) Sley, A., Jarboui, O., Ghorbel, M., Bouain, A., « Diet composition and food habits of Caranx rhonchus (Carangidae) from the Gulf of Gabes (central Mediterranean) », Journal of the Marine Biological Association of the United Kingdom, Cambridge University Press, vol. 88, no 4, , p. 831‑836 (ISSN 1469-7769, DOI 10.1017/S0025315408001379, lire en ligne )
- (en) Kompowski, A., « A study on the food and feeding habits of Trachurus trachurus, Tr. trecae, Tr. picturatus and Caranx rhonchus in the region of Cape Blanc », Acta Ichthyologica et Piscatoria, Pensoft Publishers, vol. 6, no 1, , p. 35‑57 (ISSN 1734-1515, DOI 10.3750/AIP1976.06.1.03, lire en ligne)
- (en) Gushchin, A. V., Corten, A., « Feeding of pelagic fish in waters of Mauritania: 2. Representatives of Families Carangidae, Scombridae, Pomatomidae, and Trichiuridae », Journal of Ichthyology, vol. 56, no 1, , p. 98‑106 (Tableau 3 page 101) (ISSN 1555-6425, DOI 10.1134/S0032945216010045, lire en ligne )
- (en) FAO, FAO Working Group on the Assessment of Small Pelagic Fish off Northwest Africa 2021 - Summary Report, FAO-CECAF, , 13 p. (lire en ligne), Pages 3-4
- (en) FAO, Report of the FAO/CECAF Working Group on the Assessment of Small Pelagic Fish – Subgroup South. Pointe Noire, Congo, 17–23 March 2014 / Rapport du Groupe de travail FAO/COPACE sur l´évaluation des petits poissons pélagiques – Sous-groupe Sud. Pointe Noire, Congo, 17-23 mars 2014, Rome, Italie, FAO, , 157 p. (lire en ligne ), Page 14
- (en) FAO, Report of the Working Group on the Assessment of Small Pelagic Fish of Northwest Africa, Virtual Meeting, 21–25 June 2021/Rapport du groupe de travail sur l’évaluation des petits pélagiques au large de l’Afrique nord-occidentale, Réunion virtuelle, 21-25 juin 2021, FAO, , 485 p. (ISBN 978-92-5-137012-4, DOI 10.4060/cc2467b, lire en ligne), Page 4
- (en) FAO, « Global Capture Production. Fisheries and Aquaculture Division [online] », (consulté le )
- FAO, La situation mondiale des pêches et de l’aquaculture 2022. Vers une transformation bleue, Rome, Italie, FAO, , 294 p. (ISBN 978-92-5-136461-1, DOI 10.4060/cc0461fr, lire en ligne), Page 6
- (en) FAO, The impact of COVID-19 on fisheries and aquaculture – A global assessment from the perspective of regional fishery bodies: Initial assessment, May 2020, Rome, Italie, FAO, , 38 p. (ISBN 978-92-5-132735-7, DOI 10.4060/ca9279en, lire en ligne)
- Malak, D. A., Livingstone, S. R., Pollard, D., Polidoro, B. A., Cuttelod, A., Bariche, M., Bılecenoglu, M., Carpenter, K. E., Collette, B. B., Francour, P., Goren, M., Kara, M. H., Massutí, E., Papaconstantinou, C., Tunesi, L., Aperçu du statut de conservation des poissons marins présents en mer Méditerranée, Gland, Suisse et Málaga, Espagne, UICN, , 61 p., Page 56
- (en) IUCN, « False Scad - Caranx rhonchus », sur IUCN Red List, (consulté le )
- (en) Polidoro, B., Ralph, G. M., Strongin, K., Harvey, M., Carpenter, K. E., Adeofe, T. A., Arnold, R., Bannerman, P., Nguema, J. N. B. B., Buchanan, J. R., Camara, A. K. M., Camara, Y. H., Cissoko, K., Collette, B. B., Comeros-Raynal, M. T., Bruyne, G. D., Diouf, M., Djiman, R., Ducrocq, M., Gon, O., Harold, A. S., Harwell, H., Hilton-Taylor, C., Hines, A., Hulley, P. A., Iwamoto, T., Knudsen, S., Lewembe, J. D. D., Linardich, C., Lindeman, K., Mbye, E. M., Mikolo, J. E., Monteiro, V., Mougoussi, J. B., Munroe, T., Beh, J. H. M., Nunoo, F. K. E., Pollock, C. M., Poss, S., Quartey, R., Russell, B., Sagna, A., Sayer, C., Sidibe, A., Smith-Vaniz, W., Stump, E., Sylla, M., Tito de Morais, L., Vié, J.-C., Williams, A., Red List of Marine Bony Fishes of the Eastern Central Atlantic., Gland, Switzerland, Publications Office of the International Union for the Conservation of Nature, , 81 p. (lire en ligne ), Page 63
- World Register of Marine Species, consulté le 18 décembre 2023
- (en) Jordan, D. S., Evermann, B. W., The fishes of North and Middle America : a descriptive catalogue of the species of fish-like vertebrates found in the waters of North America, north of the Isthmus of Panama, vol. 1, Washington, D.C., USA, Smithsonian Institution, United States National Museum, , 1310 p. (DOI 10.5962/bhl.title.46755, lire en ligne ), Page 916
- (en) Christopher Scharpf, « Fish Name Etymology Database », sur The ETYFish Project (consulté le )