Succinate de diéthyle
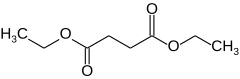
Le succinate de diéthyle est un composé organique de formule brute C8H14O4. C'est le diester d'éthyle de l'acide succinique (acide butane-1,4-dioïque).
| Succinate de diéthyle | |
| |
| Identification | |
|---|---|
| Nom systématique | butanedioate de diéthyle |
| Synonymes |
ester de diéthyle de l'acide butanedioïque, Clorius |
| No CAS | |
| No ECHA | 100.004.194 |
| No CE | 204-612-0 |
| No RTECS | WM7400000 |
| PubChem | 31249 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore à l'odeur agréable[1] |
| Propriétés chimiques | |
| Formule | C8H14O4 [Isomères] |
| Masse molaire[2] | 174,194 4 ± 0,008 6 g/mol C 55,16 %, H 8,1 %, O 36,74 %, |
| Propriétés physiques | |
| T° fusion | −21 °C[1] |
| T° ébullition | 217 °C[1] |
| Solubilité | 2 g·L-1 (eau, 25 °C)[1] |
| Masse volumique | 1,04 g·cm-3 (20 °C)[1] |
| Pression de vapeur | 6,01 |
| Point d’éclair | 94 °C (coupelle fermée)[1] |
| Pression de vapeur saturante | 1,33 hPa (55 °C)[1] |
| Propriétés optiques | |
| Indice de réfraction | 1,418-1,423[3] 1,4198 (20 °C)[4] |
| Précautions | |
| SGH[1] | |
| non dangereux au sens du SGH | |
| Écotoxicologie | |
| DL50 | 8 530 mg·kg-1 (rat, oral)[5] |
| LogP | 1,19[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Propriétés
modifierLe succinate de diéthyle se présente sous la forme d'un liquide incolore à l'odeur plaisante, faiblement soluble dans l'eau. Il est combustible mais peu inflammable et faiblement à très faiblement volatil. Il ne présente pas de risque pour l'homme, tout au plus une légère irritation en cas de contact avec les yeux[1], mais il est dangereux pour la vie aquatique[1]. Le succinate de diéthyle est une base extrêmement faible (essentiellement neutre).
Occurrence naturelle
modifierLe succinate de diéthyle est naturellement présent dans les pommes, le cacao, la mûre fraîche (Rubus laciniata L.)[6], la figue de Barbarie (Opuntia ficus indica Mill.)[7], le brandy, le whisky et le vin. Sa teneur dans le vin blanc est d'environ 0,01 à 0,8 mg/l[8]. La teneur augmente même après 10 ans en raison des processus biochimiques du vin [9].
Synthèse
modifierLe succinate de diéthyle peut être obtenu par estérification de l'acide succinique par l'éthanol[10].
Utilisations
modifierÉtant un diester, le succinate de diéthyle est un réactif particulièrement polyvalent en synthèse organique. Il peut par exemple donner la 2-hydroxycyclobutanone par condensation acyloïne[11] ; par condensation avec les esters oxaliques, c'est un précurseur de l'acide α-cétoglutarique[12]. La condensation de deux molécules de succinate de diéthyle en milieu acide donne une molécule de 2,5-dicarbéthoxy-1,4-cyclohexanedione dont les deux groupes –COO–CH2–CH3 peuvent être hydrolysés pour donner la 1,4-cyclohexanedione[13]. La synthèse de la resméthrine (en), un insecticide pyréthrinoïde, peut également être effectuée à partir du succinate de diéthyle[14]
Le succinoylsuccinate de diéthyle (en), produit par condensation basique du succinate de diéthyle, est un précurseur utile das la synthèse de colorants et pigments[15].
Le succinate de diéthyle est classifié et autorisé comme substances aromatisantes par la FAO[3] et l'Union européenne[16].
Notes et références
modifier- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Diethyl succinate » (voir la liste des auteurs) et en allemand « Bernsteinsäurediethylester » (voir la liste des auteurs).
- Entrée « Diethyl succinate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2021-01-04 (JavaScript nécessaire).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « "Specifications for Flavourings", Analytical Methods (Volume 4) - Diethyl succinate », sur FAO, (consulté le )
- (en) AMA Archives of Industrial Hygiene and Occupational Medicine, vol. 4, , p. 119
- (de) Dimitris N. Georgilopoulos and Annie N. Gallois, « Über die Aromastoffzusammensetzung von Brombeeren (Rubus laciniata L.) » [« Sur la composition aromatique des mûres (Rubus laciniata L.) »], Zeitschrift für Lebensmittel-Untersuchung und Forschung, vol. 184, , p. 374–380 (DOI 10.1007/BF01126660)
- Robert A. Flath, and Juan M. Takahashi, « Volatile constituents of prickly pear (Opuntia ficus indica Mill., de Castilla variety) », J. Agric. Food Chem., vol. 26, no 4, , p. 835-837 (DOI 10.1021/jf60218a053)
- (de) Jürgen Falbe, Manfred Regitz, RÖMPP Lexikon Chemie, 10e édition, 1996–1999 Volume 6: T - Z, Georg Thieme Verlag, (ISBN 3-13-200061-2, lire en ligne), p. 4959
- (de) Werner Back, Mikrobiologie der Lebensmittel Band 5: Getränke, Behr's Verlag, (ISBN 978-3-89947-956-0, lire en ligne), p. 212
- (en) 21st European Symposium on Computer Aided Process Engineering, (ISBN 978-0-444-53896-3, lire en ligne), p. 324
- Jordan J. Bloomfield et Janice M. Nelke, « Acyloin Condensation in Which Chlorotrimethylsilane is Used as a Trapping Agent: 1,2-Bis(Trimethylsilyloxy)Cyclobutene and 2-Hydroxycyclobutanone », Organic Syntheses, vol. 57, , p. 1 (DOI 10.15227/orgsyn.057.0001)
- E. M. Bottorff et L. L. Moore, « α-Ketoglutaric Acid », Organic Syntheses, vol. 44, , p. 67 (DOI 10.15227/orgsyn.044.0067)
- (en) Arnold T. Nielsen, Wayne R. Carpenter, William G. Dauben, E. John Deviny, « 1,4-Cyclohexanedione », Organic Syntheses, vol. 5, , p. 288 (lire en ligne, consulté le )
- (en) Thomas A. Unger, Pesticide Synthesis Handbook, William Andrew (ISBN 978-0-8155-1853-2, lire en ligne), p. 958
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a20_371), « Pigments, Organic »
- « Document 32012R0872 », Règlement d'exécution (UE) n ° 872/2012 de la Commission du 1 er octobre 2012 portant adoption de la liste de substances aromatisantes prévue par le règlement (CE) n ° 2232/96 du Parlement européen et du Conseil, introduction de ladite liste dans l’annexe I du règlement (CE) n ° 1334/2008 du Parlement européen et du Conseil et abrogation du règlement (CE) n ° 1565/2000 de la Commission et de la décision 1999/217/CE de la Commission Texte présentant de l'intérêt pour l'EEE