Rhamnose
Le rhamnose est un désoxyose, précisément un désoxyhexose du mannose.
| Rhamnose | |
| |
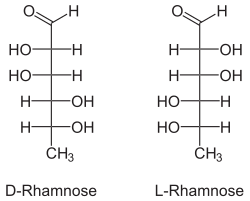
| Structure linéaire du D-(–)-Rhamnose & L-(+)-Rhamnose |
|
| Identification | |
|---|---|
| Nom UICPA | (2R,3R,4R,5R,6S)-6-méthyloxane-2,3,4,5-tétrol |
| Synonymes |
isodulcitol |
| No CAS | (L anhydre) (L monohydrate) (D) |
| No ECHA | 100.020.722 |
| No CE | 222-793-4 |
| PubChem | |
| FEMA | 3730 |
| Apparence | Solide blanc |
| Propriétés chimiques | |
| Formule | C6H12O5 [Isomères] |
| Masse molaire[1] | 164,156 5 ± 0,007 1 g/mol C 43,9 %, H 7,37 %, O 48,73 %, |
| Propriétés physiques | |
| T° fusion | 91 à 93 °C (monohydrate) |
| Solubilité | Soluble dans l'eau. |
| Masse volumique | 1,47 (monohydrate) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Chimie
modifierLe rhamnose est un 6-désoxyhexose du type aldose, il est constitué d’une chaîne de 5 éléments carbone ainsi que d’une fonction aldéhyde. Il peut être classifié soit comme un méthyl-pentose ou soit comme un 6-déoxyhexose.
La forme L-rhamnose est la forme naturelle de cet ose, ce qui est un cas rare, les autres exceptions sont le L-fucose (un méthyl pentose) et le L-arabinose (un pentose).
Origine
modifierLe L-rhamnose a été isolé à partir du nerprun (Rhamnus) et du sumac.
Il est aussi très présent dans les plantes sous forme d'hétéroside (hespéridine, ziziphine) ou sous forme de polyosides (gomme gellane, hémicellulose).
En combinaison (liaison osidique α (1→6)) avec le glucose, il forme un diholoside : le rutinose.
Le rhamnose est un composant des membranes externes de bactérie du genre Mycobacterium, qui comprend les agents de la tuberculose.
Hétéroside
modifierComme de nombreux autres oses, le rhamnose est présent dans la nature sous forme d'hétérosides appelés rhamnosides. Il en forme notamment avec les flavonoïdes, comme l'azaléine (avec l'azaléatine), la kaempféritrine (avec le kaempférol), la myricitrine (avec la myricétine) et le rutoside (avec la quercétine).
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
Voir aussi
modifierArticles connexes
modifierLiens externes
modifier- (en) 3790 L-Rhamnose NCBI database
- (en) 4826 D-Rhamnose NCBI database
- (en) COMPOUND: C00507 L-Rhamnose www.Genome.net
- (en) COMPOUND: C01684 D-Rhamnose www.Genome.net