Lupanine
La lupanine (ou 2-oxospartéine) est un composé organique tétracyclique, de formule C15H24N2O, qui appartient au groupe des alcaloïdes quinolizidiniques.
| Lupanine | |
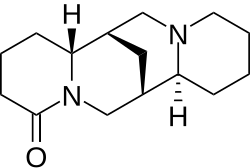
| |
| structure de la (+)-lupanine | |
| Identification | |
|---|---|
| Nom UICPA | (1S,2R,9S,10S)-7,15-diazatétracyclo[7.7.1.02,7.010,15]heptadécan-6-one |
| Synonymes |
2-oxospartéine, rel-(7R,7aS,14R,14aR)-dodécahydro-7,14-méthano-2H,11H-dipyrido[1,2-a:1',2'-e][1,5]diazocin-11-one |
| No CAS | (racémique) (+) (−) |
| PubChem | 91471 (+) |
| ChEBI | 28193 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche (+)[1] huile visqueuse (–)[2] |
| Propriétés chimiques | |
| Formule | C15H24N2O [Isomères] |
| Masse molaire[3] | 248,363 9 ± 0,014 4 g/mol C 72,54 %, H 9,74 %, N 11,28 %, O 6,44 %, |
| Propriétés physiques | |
| T° fusion | 40 °C (+)[2] 98-99 °C (racémique)[1],[2] |
| T° ébullition | 185-186 °C(+)[4] 186-188 °C (–)[4] |
| Propriétés optiques | |
| Indice de réfraction | = +61,4 ((+), acétone)[2] = -61 ((–), acétone)[2] |
| Écotoxicologie | |
| DL50 | 410 mg·kg−1 (souris, oral)[5] 175 mg·kg−1 (souris, i.p.)[5] 1440 mg·kg−1 (rat, oral)[5] 177 mg·kg−1 (rat, i.p.)[5] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Cet alcaloïde est naturellement présent chez les espèces de plantes de la famille des Fabaceae, en particulier dans les genres Lupinus, Genista, Ormosia et Cytisus. C'est souvent le principal alcaloïde de ces plantes, accompagné, en général, de divers alcaloïdes mineurs tels que la spartéine, la baptifoline et l'anagyrine. On le trouve aussi chez certaines espèces du genre Leontice (Berberidaceae)[6].
Histoire
modifierLe nom de ce composé provient de son occurrence dans le genre Lupinus. Lorsque Max Hagen la décrivit pour la première fois en 1885, il nomma la substance qu'il avait obtenue, la lupanine, afin de la distinguer des substances déjà connues, la lupinine et la lupinidine. L'extraction a été réalisée au moyen d'acide chlorhydrique sur des graines du lupin bleu, puis traitée avec une solution d'hydroxyde de potassium et de l'éther de pétrole, le composé étant obtenu sous la forme d'un sirop de couleur miel clair au goût amer[7],[8]. La lupanine a été synthétisé pour la première fois,en 1956[9]. La première synthèse totale énantiosélective des énantiomères (+) et (–) a été réalisée en 2018 à partir de 2,4,6,8-tétraoxobispidine (3,7-diazabicyclo[3,3,1]nonan-2,4,6,8-one), préparée à partir de malonate de diméthyle[10].
Occurrence
modifierLa lupanine se trouve naturellement dans les genres de la famille des Fabaceae, tels que Lupinus, Genista ou Cytisus, et qui est souvent le principal alcaloïde de ces plantes, ainsi aussi que chez certaines espèces du genre Leontice (en). En général, ce composé est accompagné de divers alcaloïdes mineurs tels que la spartéine, la baptifoline et l'anagyrine[2]. Le lupin blanc contient le lupanine racémique, tandis que le lupin bleu contient principalement l'énantiomère (+). La teneur en lupanine dans les graines de lupin est généralement comprise entre 50 et 70% des alcaloïdes, à l'exception du lupin jaune[11].
Biosynthèse
modifierLa biosynthèse de la lupanine est réalisée à partir de la lysine au moyen de l'enzyme lysine décarboxylase en cadavérine. Au cours d'une réaction du pyruvate sur l'alanine, trois équivalents de cadavérine sont convertis en lupanine via un intermédiaire inconnu[12]. La présence de lupanine plutôt que de spartéine et l'apparition d'hydroxylupanine au lieu de lupanine seraient contrôlées par un gène dominant[7].
Extraction et synthèse
modifierLa substance est généralement obtenue lors d’une extraction Soxhlet de graines de lupin au moyen de solvants organiques tels que le n-hexane ou l’éther de pétrole. La (±)-lupanine obtenue de cette manière peut être résolue en énantiomère pur au moyen d'une résolution du racémique, la recristallisation utilisée à cette fin peut être effectuée avec de l'acide 2,3-dibenzoyltartrique énantiomériquement pur[1].
Alternativement, la lupanine peut être préparée par synthèse. Pour la synthèse énantiosélective de la (–)-lupanine, on fait réagir la 2,4,6,8-tétraoxobispidine avec le (1S)-1-phényléthanol dans une réaction de Mitsunobu, suivie d'une réduction diastéréosélective en deux étapes. L'auxiliaire chiral est éliminé dans une réduction de Birch et l'intermédiaire bicyclique est converti dans une cyclisation α,N à plusieurs étages en un nouvel intermédiaire tricyclique. Celui-ci est réduit avec du borohydrure de sodium et allylé dans une réaction de Hosomi-Sakurai pour éliminer le groupe protecteur Boc. Lors du renouvellement de la N-allylation, une métathèse de fermeture du cycle catalysée par le catalyseur de Grubbs II se produit qui par hydrogénation, donne le composé cible, la (–)-lupanine[10].
Propriété
modifierDes effets pharmacologiques anti-arythmiques, hypotenseurs et hypoglycémiants ont été décrits pour la lupanine[2]. L'angle de rotation spécifique d'une solution d'acétone contenant presque 3% du produit est [α]D = ±61°[2] et [α]D20 = ±81,2° pour une solution d'éthanol 1M. Le (+)-2,3-dibenzoyl-D-tartate de (–)-lupanine cristallise dans le groupe d'espace tétragonal P43 (no 78) avec les constantes de réseau a = 1,0906 nm et c = 2,7233 nm[1].
Notes et références
modifier- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Lupanin » (voir la liste des auteurs).
- Anna K. Przybył, Maciej Kubicki, Simple and highly efficient preparation and characterization of (−)-lupanine and (+)-sparteine, Tetrahedron, 2011, vol. 67(40), pp. 7787–7793. DOI 10.1016/j.tet.2011.07.080.
- (de) « Lupanin », sur Römpp Online, Georg Thieme Verlag (consulté le )
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- George Roger Clemo, Richard Raper, Charles Robert Sydney Tenniswood, The Lupin Alkaloids. Part III., Journal of the Chemical Society, 1931, vol. 0, pp. 429–437. DOI 10.1039/JR9310000429.
- (en) « Lupanine », sur ChemIDplus.
- (en) « KNApSAcK Metabolite Information », sur www.knapsackfamily.com (consulté le ).
- Dieter Heß, Biochemische Genetik. Eine Einführung unter besonderer Berücksichtigung höherer Pflanzen, Springer Verlag, 2013, chap. 6, pp. 106–109. (ISBN 978-3-642-85766-9), googlebook une page.
- Max Hagen, Ueber das Lupanin, ein Alaloïd aus dem Samen der blauen Lupine, Lupinus angustifolius, Justus Liebigs Annalen der Chemie, 1885, vol. 230(3), pp. 367–384. DOI 10.1002/jlac.18852300308.
- G. R. Clemo, R. Raper, J. C. Seaton, The lupin alkaloids. Part XVI. The synthesis of externally compensated lupanine, Journal of the Chemical Society, 1956, vol. 0, pp. 3390–3394. DOI 10.1039/JR9560003390.
- Dagmar Scharnagel, Jessica Goller, Nicklas Deibl, Wolfgang Milius, Matthias Breuning, The Enantioselective Total Synthesis of Bisquinolizidine Alkaloids: A Modular “Inside‐Out” Approach, Angewandte Chemie International Edition, 2018, vol. 57(9), pp. 2432–2435. DOI 10.1002/anie.201712852.
- (de) Michael Wink, (pdf)Methoden zum Nachweis von Lupinen-Alkaloiden sur uni-heidelberg.de.
- Gerhard Richter, Stoffwechselphysiologie der Pflanzen. Physiologie und Biochemie des Primär- und Sekundärstoffwechsels, Georg Thieme Verlag, 1998, chapitre 12, pp. 517–518. (ISBN 978-3-13-442006-7), googlebook page 518.
