Immunoglobuline E
L’immunoglobuline E (IgE) est une classe d'anticorps (isotype) présente uniquement chez les mammifères et qui a été découverte et caractérisée en 1966 par Teruko Ishizaka et par son mari Kimishige Ishizaka — ce qui a valu à ce dernier le prix japonais de l'an 2000[1].
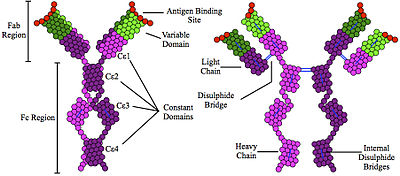
Les immunoglobulines IgE sont associées aux maladies atopiques, notamment les rhinites allergiques, l'asthme et les dermatites atopiques, mais sont également impliquées dans les mécanismes de défense immunitaire face aux infections parasitaires.
Découverte
modifierLes IgE sont découvertes simultanément en 1966 et 1967 par deux groupes indépendants[2] : Kimishige Ishizaka avec Teruko Ishizaka au Children's Asthma Research Institute and Hospital de Denver[3], et Gunnar Johansson avec Hans Bennich (sv) à Uppsala[4]. Leur article commun est publié en avril 1969[5].
Liens avec certaines allergies
modifierLes immunoglobulines de classe E (IgE) sont présentes à des niveaux peu élevés dans le plasma et sont principalement produites par les plasmocytes dans le tissu lymphoïde associé aux muqueuses.
Les patients qui souffrent de conditions atopiques, comme l'asthme, la rhinite allergique ou la dermatite atopique, ont dans leur sérum des niveaux élevés en IgE totaux ainsi qu'en IgE spécifiques pour les antigènes responsables de ces maladies. En effet, lors de leur premier contact avec un allergène, sont produites des IgE spécifiques à l'allergène (pollen, protéines alimentaires, acariens…), grâce à l'activation de lymphocytes T et B. Cette phase (dite initiatrice) de sensibilisation est cliniquement silencieuse.
Lors de contacts répétés avec le même allergène (phase effectrice), les IgE vont être produites en grande quantité par les lymphocytes B. Les IgE se fixent alors sur les granulocytes basophiles, éosinophiles et les mastocytes, entraînant des réactions inflammatoires. Cette cascade de réactions inflammatoires va libérer de l'histamine (médiateur préformé à partir de l'acide aminé : histidine) et d'autres médiateurs de la réaction allergique dans le sang (médiateurs néoformés, le plus souvent dérivés de l'acide arachidonique : majoritairement les leucotriènes et les prostaglandines). Cette phase n'est plus cliniquement silencieuse. Elle peut conduire à un choc anaphylactique. Les conséquences de l'allergie sont la vasodilatation (causant des œdèmes), la bronchoconstriction et la production de mucus, dues à la stimulation des récepteurs H1 à l'histamine (les autres médiateurs, leucotriènes et prostaglandines, produisent les mêmes effets, plus tardivement mais prolongés et plus intenses).
Récepteur
modifierIl existe deux types de récepteurs aux IgE FcεRI (de haute affinité) et FcεRII (de faible affinité).
FcεRI
modifierLes mastocytes et les basophiles sont porteurs de récepteurs FcεRI dits de haute affinité, dont la densité est de l'ordre de 2-3 × 105 molécules par cellule. Il est composé d'une chaîne α, qui capte l'IgE, d'une chaîne β et de deux chaînes γ (identiques unies par des ponts disulfures) ; ces trois dernières participant au transfert du signal de dégranulation (motifs ITAM)[6].
FcεRII
modifierIl existe aussi un récepteur FcεRII (CD23) dit de faible affinité, qui se retrouve entre autres sur les lymphocytes B et pourrait jouer un rôle dans la présentation de complexes immuns contenant des anticorps IgE aux lymphocytes T. Ce récepteur est essentiellement présent sur les éosinophiles mais on a rapporté sa présence sur la membrane plasmique des macrophages alvéolaires, des plaquettes et des lymphocytes[7].
Dosage sérique
modifierLe taux d'IgE circulant est bas (concentration sérique < 1 µg/ml) parce que :
- la demi-vie de l'IgE sérique est plus courte que celle des autres immunoglobulines (+/- 2,5 à 4 jours par rapport à 21 jours pour les IgG). En fait, le sérum est en permanence capté par les cellules endothéliales (endocytose) et la plupart des macromolécules, y compris les IgE, sont ainsi dégradées dans les endosomes. Le pH acide y favorise la digestion des Ig par les cathepsines. L'IgG échappe à ce catabolisme grâce à sa liaison au récepteur néonatal FCγRn ;
- les IgE produites sont rapidement liées aux mastocytes et aux leucocytes basophiles qui possèdent des récepteurs de haute affinité pour le fragment Fc de l'IgE. Une fois liée, l'IgE persiste à la surface de ces cellules pendant plusieurs semaines ;
- l'IgE est produite en petite quantité et uniquement en réponse à certains antigènes particuliers, parasitaires ou allergènes. À noter que la position de la partie génique qui encode la région constante de l'IgE se trouve à l’extrémité distale du gène des immunoglobulines. Mais la position ne peut expliquer à elle seule la rareté de la commutation vers l'IgE.
Le dosage des IgE totales permet d'effectuer un premier dépistage grossier à la recherche soit d'une allergie soit d'une parasitose à helminthes (helminthiases). Dans ces pathologies, le taux d'IgE totale est généralement augmenté.
Le dosage des IgE spécifiques (RAST test) d'un composé permet d'affirmer ou d'infirmer la présence d'une allergie à ce composé. Actuellement[Quand ?], les recommandations sont de dépister dans un premier temps les IgE spécifiques sur un mélange d'allergènes (Phadiatop et Trophatop) avant de prescrire les dosages d'IgE spécifiques d'un ou de plusieurs composés.
Cible thérapeutique
modifierL'omalizumab est un anticorps monoclonal ciblant la partie Fc de l'immunoglobuline E. Il permet d'améliorer les symptômes de l'asthme allergique[8].
Notes et références
modifier- (en) « Laureates of the Japan Prize », The Japan Prize Foundation (ja) (consulté le ).
- (en) D. R. Stanworth, « The discovery of IgE », Allergy, vol. 48, no 2, , p. 67–71 (ISSN 0105-4538 et 1398-9995, DOI 10.1111/j.1398-9995.1993.tb00687.x, lire en ligne, consulté le )
- K. Ishizaka, T. Ishizaka et M. M. Hornbrook, « Physico-chemical properties of human reaginic antibody. IV. Presence of a unique immunoglobulin as a carrier of reaginic activity », Journal of Immunology (Baltimore, Md.: 1950), vol. 97, no 1, , p. 75–85 (ISSN 0022-1767, PMID 4162440, lire en ligne, consulté le )
- S. G. Johansson et H. Bennich, « Immunological studies of an atypical (myeloma) immunoglobulin », Immunology, vol. 13, no 4, , p. 381–394 (ISSN 0019-2805, PMID 4168094, PMCID 1409218, lire en ligne, consulté le )
- (en) Teruko Ishizaka, Kimishige Ishizaka, S. Gunnar O. Johansson et Hans Bennich, « Histamine Release from Human Leukocytes by Anti-λE Antibodies », The Journal of Immunology, vol. 102, no 4, , p. 884–892 (ISSN 0022-1767 et 1550-6606, DOI 10.4049/jimmunol.102.4.884, lire en ligne, consulté le )
- « Le récepteur de forte affinité pour l’IgE : leçons d’une analyse structurale » [PDF], sur erudit.org, (consulté le ).
- « Immunoglobulines E, anticorps de l'allergie »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur weballergies.com (consulté le ).
- (en) J. V. Fahy, H. E. Fleming, H. H. Wong, J. T. Liu, J. Q. Su, J. Reimann, R. B. Fick Jr, and H. A. Boushey, « The effect of an anti-IgE monoclonal antibody on the early- and late-phase responses to allergen inhalation in asthmatic subjects », American Journal of Respiratory and Critical Care Medicine (en), 1997, vol. 155, p. 1828-1834.
Voir aussi
modifierArticles connexes
modifierLiens externes
modifier
- Ressources relatives à la santé :