Minoxidil
Le minoxidil est un puissant vasodilatateur, initialement utilisé pour soigner l’hypertension artérielle. Il est aujourd'hui le plus souvent utilisé sous forme de solutions topiques, titrées à 2 ou 5%, pour lutter contre l'alopécie androgénétique.
| Minoxidil | ||
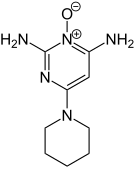
| ||
 | ||
| Structure chimique en 2 dimensions et structure moléculaire en 3 dimensions du Minoxidil | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 6-(1-pipéridinyl)pyrimidine-2,4-diamine 3-oxyde | |
| Synonymes |
6-(1-pipéridinyl)-2,4-pyrimidinediamine 3-oxyde |
|
| No CAS | ||
| No ECHA | 100.048.959 | |
| No CE | 253-874-2 | |
| No RTECS | UV8200000 | |
| Code ATC | C02, D11 | |
| DrugBank | DB00350 | |
| PubChem | 4201 | |
| ChEBI | 6942 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C9H15N5O [Isomères] |
|
| Masse molaire[2] | 209,248 3 ± 0,009 6 g/mol C 51,66 %, H 7,23 %, N 33,47 %, O 7,65 %, |
|
| pKa | 4,61[1] | |
| Propriétés physiques | ||
| T° fusion | 248 °C[1] 262-280 °C (dec.)[3] 272-274 °C (dec.)[4] |
|
| Solubilité | eau : 2,200 g/L[1] | |
| Précautions | ||
| SGH[3],[4] | ||
| H302, H311, H315, H319, H330, H335, P260, P261, P310, P320, P338, P361, P405 et P501 |
||
| Données pharmacocinétiques | ||
| Métabolisme | Métabolisé à 85 % par le foie (glycuronides) | |
| Demi-vie d’élim. | 22 heures par voie topique | |
| Excrétion |
Voie rénale : 15 % sous forme inchangée et 85 % sous forme de métabolites (glycuronides) |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Plusieurs hypothèses ont été formulées pour expliquer son action sur l'alopécie androgénétique (amélioration de la vascularisation des papilles dermiques, ouverture des canaux potassiques, amélioration du cycle folliculaire)[5] sans toutefois apporter de réponse définitive. Des études récentes ont mis en avant son rôle de perturbateur endocrinien et son action inhibitrice sur les récepteurs androgènes[6].
Historique
modifierAux Etats-Unis
modifierFin des années 1950 à 1965 : découverte du minoxidil
modifierÀ la fin des années 1950, l'entreprise pharmaceutique Américaine the Upjohn Company située au Michigan (devenu plus tard une partie de Monsanto et Pfizer [7],[8],[9]), fait des essais en laboratoires pour traiter les ulcères[10]. L'entreprise porte son intérêt sur un composé chimique de synthèse dérivé d'acide barbituriques[11],[12], lui-même dérivé de la pyrimidine[13],[9]. Dans les premiers essais utilisant des chiens, le composé chimique ne guérit pas les ulcères, mais s'avère être un puissant vasodilatateur[10],[9].
L'entreprise synthétise plus de 200 variations dérivées de ce composé chimique, y compris celui qu'elle développera entre 1963 et 1965, qu'elle nommera minoxidil[9],[10].
1967-1974 : tests cliniques et nouvelle application
modifierEn 1967, la FDA (Food and Drug Administration) autorise l'entreprise Upjohn à faire des tests cliniques sur les êtres humains[10],[9]. L'entreprise engage le docteur Charles Chidsey, professeur agrégé de médecine à l'Université du Colorado School of Medicine de Denver, afin de mener deux études cliniques sur des patients atteints de troubles cardio-vasculaires.
À la fin de l'année 1967/1968, le docteur Chidsey débute sa première étude[9],[14],[10].
Entre 1970 et 1971, durant la deuxième étude, le docteur constate que certains patients sous minoxidil présentent comme effet secondaire, un développement pileux sur l'ensemble du corps et un recul d'alopécie androgénétique. Il consulte plusieurs collègues endocrinologues et dermatologues, afin de déterminer son origine. L'origine hormonale étant écartée, il consulte le docteur Guinter Kahn, qui est dermatologue travaillant dans le même établissement, sur une possible utilisation du minoxidil pour un traitement de l'alopécie androgénétique[9],[15],[10].
Le docteur Chidsey obtient de l'entreprise Upjohn, une autorisation de délivrer du minoxidil pur au docteur Kahn afin d'étudier cet effet secondaire, avec comme condition de mener ces recherches sous le contrôle du docteur Chidsey[9].
En 1973, après de nombreuses expériences, le docteur Kahn aidé de son collègue le docteur Grant, obtiennent des résultats satisfaisants sur un patient présentant une alopécie, en utilisant une solution de 1 % de minoxidil dissous dans de l'alcool puis appliquée quotidiennement sur le cuir chevelu du patient. Cependant, ils n'informent pas le docteur Chidsey de ces résultats[9],[10].
En 1974, le docteur Kahn et le docteur Grant essayent de breveter discrètement leurs travaux, mais ils constatent que l'entreprise Upjohn a breveté le même médicament en utilisant la majorité de leurs recherches, et seul le nom du docteur Chidsey est inscrit sur le brevet[9],[10].
En 1979 : lancement de Loniten
modifierEn 1979, pendant que le docteur Kahn bloque le brevet depuis cinq ans, l'entreprise Upjohn obtient une autorisation de mise sur le marché du médicament Loniten, destiné aux malades souffrant d'une hypertension artérielle sévère[16],[9],[10].
Le médicament se présente sous forme de comprimés sécables (en tablettes de 2,5 mg et 10 mg) à administrer par voie orale. Il est composé de minoxidil et d’excipients tels que : cellulose microcristaline, amidon de maïs, lactose, stéarate de magnésium, dioxyde de silicium[16].
1986-1988 : lancement de Rogaine
modifierEn 1986, la longue bataille administrative qui a duré plusieurs années opposant le docteur Kahn à l'entreprise Upjohn prend fin. Le docteur obtient un accord lui permettant de faire inscrire son nom sur le brevet (US # 4,596,812 Charles A Chidsey, III et Guinter Kahn). Il obtient également de l'entreprise un pourcentage sur les chiffres d'affaires[9],[10]. Le brevet appartient désormais à l'entreprise Upjohn[9].
Le , une autorisation de mise sur le marché est accordée au médicament Rogaine à 2 % de minoxidil, indiqué dans le traitement de l'alopécie androgénétique chez les hommes[17] ,[18] (il sera distribué en Europe sous le nom de Regaine et en France sous les noms de Alostil et Regaine). Le médicament se présente sous forme liquide en flacon de 60 ml et muni d'une pipette graduée. Il est composé de minoxidil, propylène glycol, alcool, eau purifiée.
En 1991, les ventes du médicament Rogaine restent au plus bas depuis 3 ans, les patients ne s'y intéressent pas[19]. L'image de l'entreprise Upjohn est ternie par une affaire sur un autre médicament, pour lequel plus d'une centaine de poursuites sont engagées contre l'entreprise[20],[19]. Elle entreprend ensuite pour Rogaine la troisième campagne publicitaire la plus chère du monde pour un médicament, à 50 millions de dollars[19]. L'entreprise fait également du démarchage auprès des médecins pour promouvoir son médicament Rogaine, mais la FDA désapprouve ces méthodes[19]. Elle réussit également à obtenir une autorisation pour rendre son médicament Rogaine disponible aux femmes souffrant d'une alopécie androgénétique [18],[21]. Puis la campagne publicitaire fonctionne et les ventes augmentent de 30 %[19], mais les prix du médicament Rogaine restent élevés[21].
La disponibilté de Rogaine pour le grand public a considérablement augmenté en 1996. Le 12 Février 1996, la FDA approuve la production de formulations génériques de Minoxidil et sa vente sans prescription. Déterminée à rester un acteur incontournable de la vente de minoxidil, l'entreprise Upjohn lance en 1997 une nouvelle formulation, titrée à 5%, associée à une campagne de publicité pour promouvoir la force accrue de cette nouvelle formulation[17].
Le , le Lonoten (minoxidil oral pour l’hypertension artérielle) est repris sous la marque Pfizer[22],[23] ,[24](il sera distribué dans d'autres pays dont la France sous le nom de Lonoten par Pfizer[25]). Durant sa période de mise sur le marché de 1979 à 2005, il a été pratiqué des autopsies sur 150 patients décédés de causes diverses et utilisant le Lonoten. Elles n’ont pas permis d’identifier formellement la responsabilité du médicament pour ces décès[16].
En 2007, l'entreprise pharmaceutique Américaine Johnson & Johnson acquiert le médicament Rogaine (elle acquiert également Regaine et Alostil), lors d'un achat d'une partie des médicaments de Pfizer pour 17 milliards de dollars[26],[27].
En France
modifierEn 1983 : entrée du minoxidil sur le territoire national
modifierLe , une autorisation de mise sur le marché français est accordée au médicament lonoten[28].
Le , le minoxidil sous toutes ses formes ainsi que ses dérivés, est inscrit sur la liste du tableau A des substances vénéneuses de la médecine humaine par l'arrêté du [29].
Le , une autorisation de mise sur le marché est accordée au médicament Regaine à 2 % de minoxidil pour application locale en flacon de 60 ml (sa commercialisation en France sera arrêtée le )[30], ainsi qu'une autorisation de mise sur le marché du médicament Alostil à 2 % de minoxidil pour application locale en flacon de 60 ml[31].
Le , le minoxidil sous forme topique ainsi que ses dérivés, sont inscrits sur la liste du tableau C des substances vénéneuses de la médecine humaine par l'arrêté du [29].
Le , 4 autorisations de mise sur le marché sont accordées le même jour pour :
- le médicament "Minoxidil Cooper" à 2 % de minoxidil, pour application locale en flacon de 60 ml et distribué par l'entreprise Coopération Pharmaceutique Française[32] ;
- le médicament "Minoxidil Sinclair" à 2 % de minoxidil, pour application locale en flacon de 60 ml et distribué par l'entreprise pharmaceutique Sinclair Pharma France[33] ;
- le médicament "Minoxidil RPG" à 2 % de minoxidil, pour application locale en 30 ampoules de 1 ml chacune et distribué par l'entreprise pharmaceutique Ranbaxy Pharmacie Génériques[34] ;
- le médicament "Minoxidil CS" à 2 % de minoxidil, pour application locale en 30 ampoules de 1 ml chacune et distribué par l'entreprise pharmaceutique CS[35].
1990 : nouvelles législations
modifierLe , une modification des arrêtés du et du est faite par l'arrêté du [36] toujours en vigueur, qui simplifie les classements des substances vénéneuses en deux listes : la liste I et la liste II, qui comprend les substances classées dangereuses nécessitant une surveillance médicale, et les substances susceptibles de présenter directement ou indirectement un danger sur la santé. Le minoxidil est classé sur les deux listes.
2001 : interdiction française d'incorporation dans les produits cosmétiques
modifierLe , le minoxidil sous toutes ses formes ainsi que ses dérivés, est inscrit sur la liste des substances interdites en France entrant dans la composition des produits cosmétiques, par l'arrêté du [37].
2005 : entrée du minoxidil pour application locale dosé à 5 %
modifierLe , une autorisation de mise sur le marché est accordée au médicament "Minoxidil Sandoz Conseil" à 5 % de minoxidil, pour application locale en flacon de 60 ml et distribué par l'entreprise pharmaceutique Sandoz[38].
Le , une autorisation de mise sur le marché est accordée au médicament "Minoxidil Bailleul" à 5 % de minoxidil, pour application locale en flacon de 60 ml et distribué par l'entreprise pharmaceutique Laboratoires Bailleul[39].
Les autres groupes pharmaceutiques possédant déjà des médicaments à applications locales dosés à 2 % de minoxidil, obtiendront également après cette date une AMM pour des traitements dosés à 5 % de minoxidil.
2009 : interdiction européenne d'incorporation dans les produits cosmétiques
modifierLe , le minoxidil sous toutes ses formes ainsi que ses dérivés, sont inscrits sur la liste des substances interdites dans l'Union européenne entrant dans la composition des produits cosmétiques par l'article du règlement (CE) n°1223/2009 du Parlement européen et du Conseil du relatif aux produits cosmétiques[40].
En 2012 : autorisation de commercialisation sans prescription médicale
modifierle , une autorisation partielle est accordée au minoxidil sous sa forme topique à la prescription sans ordonnance[41], mais il demeure inscrit sur la liste des substances vénéneuses[36].
Le médicament Lonoten (pour l'hypertension artérielle) est remboursé par la sécurité sociale à hauteur de 65 %[28],[42]et ne dispose d'aucun médicament générique[42]. Son prix ne peut pas être modifié par les pharmaciens[43], puisqu'il est inscrit sur la liste des médicaments remboursables[28].
Le médicament pour application locale n'est pas remboursé par la sécurité sociale[44]. Il est disponible sous différentes versions génériques depuis que l'entreprise Pharmacia & Upjohn a perdu les droits de brevet en 1996[9]. Les pharmaciens sont libres de fixer son prix[44].
Le minoxidil, qu'il soit sous forme topique à application locale, ou sous forme comprimée par voie orale, est un médicament potentiellement dangereux pour la santé[3]. En tant que médicament, sa vente en France est strictement réservée aux pharmacies françaises[45],[46],[47] inscrites sur la liste de l'Ordre national des pharmaciens[46],[47], et interdite aux moins de 18 ans[41].
Efficacité
modifierPlusieurs études ont montré une efficacité du traitement de l'alopécie androgénétique par le Minoxidil topique 2% et 5%, à la fois chez la femme[48] et l'homme[49]. Une étude portant sur 31 hommes traités pendant 5 ans par du Minoxidil 2% ou 3% situe le pic d'efficacité après 1 an de traitement (nombre de cheveux par cm² maximal), avec un léger déclin dans les années suivantes[49].
Le traitement doit être continué indéfiniment car son arrêt entraîne la perte des cheveux préalablement repoussés après 3-4 mois[49].
Difficultés de mise en œuvre
modifierL' utilisation du Minoxidil est loin d’être évidente. La difficulté est ce décalage entre le soin et la constatation de la réponse au traitement d'environ trois mois, par exemple, pour un mal de tête, seules quelques heures après la prise d’un médicament suffisent. Pour commencer le traitement, il faudra donc attendre cette longue période sans défaillance avant d’apprécier les résultats et continuer de la sorte pour les maintenir.
Ainsi, l’efficacité du traitement est source de confiance et incite souvent à la négligence, seuls quelques jours d'arrêt suffisent pour provoquer une importante perte de cheveux quelques mois plus tard, une situation qui conduit souvent à l’abandon.
Mécanisme d’action
modifierLe mécanisme d'action complet du minoxidil demeure inconnu sur le corps humain[50].
Différentes causes ont été proposées pour expliquer l'effet du Minoxidil sur l'alopécie androgénétique. Le minoxidil active l'ouverture des canaux potassiques, augmentant la concentration des cellules en ions potassiums et bloquant l'entrée des ions calciums. Cela pourrait diminuer l'impact inhibiteur du facteur de croissance épidermique sur le développement du cheveu[51]. De plus, il a été suggéré que les effets du minoxidil sont liés à l'activité de la sulfotransférase et que le minoxidil nécessite d'être métabolisé par la sulfotransférase en sulfate de minoxidil (métabolite actif) pour être efficace[51].
Le minoxidil est moins efficace lorsqu'il y a une grande zone de perte de cheveux. En outre, son efficacité a été largement démontrée chez les hommes dont la perte de cheveux a débuté depuis moins de cinq ans. Deux études cliniques sont menées aux États-Unis, pour concevoir un dispositif médical qui pourrait permettre aux patients, de déterminer s'ils sont susceptibles d'échouer au traitement de minoxidil avant de le commencer[52].
Toxicité
modifierLe Minoxidil possède deux métabolites: le glucuronide (minoxidil-O-glucuronide) et le sulfate de minoxidil (minixodil-N-O-sulfate) qui sont métabolisés par le foie puis excrétés par le rein. Le sulfate de minoxidil est le métabolite le plus actif[53].
Chez l'homme, l'ingestion d'une quantité de Minoxidil supérieure à 1 gramme suffit à provoquer des symptômes extrêmement graves (tachycardie, hypotension, choc réfractaire, œdème pulmonaire etc.) nécessitant entre 9 à 12 jours d'hospitalisation, en situation d'urgence vitale[54],[55].
Les patients hospitalisés après une intoxication au Minoxidil présentent souvent une persistance de l'effet hypotenseur durant 3-4 jours malgré la courte demi-vie du Minoxidil et ses métabolites (moins de 4h). Une explication réside dans le grand volume de distribution du minoxidil (moyenne de 197L dans les sujets sains) et sa capacité à persister localement au niveau de certains tissus (par exemple, les muscles lisses)[53]. Cela pourrait expliquer la persistance d'effets secondaires chez le sujet sain, souvent plusieurs semaines après l'arrêt du traitement[56].
Il faut cependant noter qu’en cas de surdosage, tous les médicaments sont toxiques. Par exemple, il suffit près de 12 fois la dose journalière, soit 12 grammes d’aspirine[57] pour causer une intoxication grave. La dose de 1 gramme de minoxidil relatée plus haut représente plus de 700 fois la dose journalière absorbée par voie topique (sur le cuir chevelu)[49].
Grossesse et allaitement
modifierLes données sur la tératogénicité (capacité à provoquer des malformations embryonnaires) du Minoxidil sont limitées. A ce stade, aucun effet secondaire sérieux sur l'embryon n'a été mentionné[49]. Par précaution, les médecins et autorités de santé conseillent cependant de suspendre le traitement pendant la grossesse et l'allaitement[49].
Posologie
modifierPour le traitement de l'hypertension artérielle, le Minoxidil est commercialisé sous la marque Lonoten. Il est utilisé par voie orale sous la forme de comprimés contenant 5 ou 10 mg de substance active[58]. La dose de départ est habituellement fixée à 2.5 mg/jour, avec une augmentation possible tous les 3-4 jours en cas de résistance de l'effet hypertenseur[59].
Au moins 95% du Minoxidil administré oralement est absorbé par l'appareil digestif et métabolisé par le foie[53]. Un patient prenant un comprimé de 2.5 mg de Lonoten absorbera donc une quantité de substance active proche de 2.4 mg.
Pour le traitement de l'alopécie androgénétique, le Minoxidil est commercialisé sous les marques Bailleul, Cooper, Alopexy et Alostyl. Il est utilisé sous forme de solution topique ou de mousse, titrées à 2 ou 5%[49]. Le traitement consiste à appliquer 1 mL de Minoxidil 2 fois/jour[60]. A chaque application, la quantité de substance active utilisée est donc de 50 mg pour le Minoxidil 5% (respectivement 20 mg pour le Minoxidil 2%).
A peu près 1.4% du Minoxidil topique est absorbé par le cuir chevelu et se retrouve dans la circulation sanguine, bien que la fréquence d'utilisation et les irritations cutanées puissent augmenter ce niveau d'absorption moyen[49]. En moyenne, l'application de 1 mL de Minoxidil topique 2 fois par jour entraîne donc l'absorption de 1.4 mg de substance active dans la circulation sanguine.
Effets secondaires
modifierListe des effets secondaires connus
modifierLes effets secondaires les plus fréquents du Minoxidil topique 2% ou 5% se décomposent ainsi:
- irritations et démangeaisons au niveau du point d'application. Cet effet secondaire, l'un des plus fréquents, n'est pas seulement dû à la substance active mais aussi aux adjuvants, comme le propylène glycol, utilisés dans les mousses ou solutions liquides[61].
- effets cardiaques (douleurs thoraciques, tachycardie, palpitations...). Parmi les complications cardiaques les plus graves, des coronopathies ont été rapportées. Elles sont probablement dues à un accroissement de la demande en oxygène car la prise de Minoxidil augmente la fréquence et le débit cardiaques. Des cas d' hypertensions pulmonaires ont aussi été rapportés[61].
- effets sexuels (baisse de libido, difficultés érectiles, baisse de qualité du sperme...)[5],[56]
- hypertrichose, c'est-à-dire la croissance de poils sur des zones non traitées (visage, oreilles, jambes, etc.). Cet effet se produit plus souvent chez les femmes que chez les hommes. Il nécessite en général plusieurs mois d'arrêt du traitement pour se résorber (1-3 mois pour le visage et les bras, 4-5 mois pour les jambes)[61].
Plus rarement, les effets secondaires suivants ont été rapportés:
- vertiges, nausées et maux de tête[5].
- œdèmes au niveau du visage, notamment chez les femmes[5]. La rétention de fluide fait partie des effets notoires du Minoxidil et nécessite de surveiller la prise de poids en début de traitement[59]. Un épanchement péricardique se produit chez près de 5% des patients traités par Minoxidil oral pour des raisons inconnues[61].
- troubles de la vision, en particulier diminution de l'acuité visuelle et choriorétinopathies[5],[62],[63]. Chez certains patients, le Minoxidil diminue la micro-circulation rétinienne, entrainant parfois des complications graves, comme des occlusions de la veine centrale de la rétine[64].
- crises d'angoisse[5].
Études et témoignages
modifierUne étude randomisée en double aveugle de 1988 [65] a mis en évidence les effets sur le cœur du Minoxidil topique. Elle indique que des patients chauves traités par du Minoxidil topique présentaient après 6 mois d'application une augmentation du débit cardiaque de 3-5 battements/minute par rapport au groupe témoin. De plus, les patients traités par le Minoxidil présentent également un accroissement du ventricule gauche de l'ordre de 5g/m2 après 6 mois. Les auteurs concluent que le Minoxidil pourrait augmenter les problèmes cardiaques chez les personnes sujettes à une insuffisance coronarienne. Les auteurs s'inquiètent également de l'hypertrophie du ventricule gauche chez les sujets sains. Dans le cas de thérapies de long terme (plusieurs années), cette augmentation massique pourrait entraîner des complications.
Chez le sujet sain, les effets sur le cœur du Minoxidil se manifestent parfois par des douleurs thoraciques, des essoufflements (dyspnées) ou l'accélération soudaine du rythme cardiaque (tachycardie). Un patient de 34 ans, sans maladie cardiaque, décrit par exemple la survenue de fortes douleurs à la poitrine et d'essoufflement après plus de 3 ans d'utilisation quotidienne du Minoxidil. Des examens cliniques ont montré une taille anormalement élevée de son muscle cardiaque (plus de 13cm), malgré l'absence d'anomalies génétiques ou de maladies expliquant l'hypertrophie. Après l'arrêt du Minoxidil, les douleurs thoraciques ont cessé et le muscle cardiaque a repris sa taille normale (12 cm)[66].
Plusieurs centaines de témoignages indiquent la survenue de problèmes sexuels liés à l'utilisation de Minoxidil topique 5%[56].Les effets secondaires décrits sont presque toujours les mêmes: baisse de la libido, difficultés érectiles, diminution de taille du pénis. Ces effets secondaires sexuels sont peu documentés et mériteraient d'être étudiés. De nombreux patients indiquent par ailleurs la persistance de ces problèmes sexuels dans le temps, parfois plusieurs années après l'arrêt du traitement. Les analyses sanguines révèlent souvent des taux de prolactine en excès et un dérèglement des hormones sexuelles mâles.
Voir aussi
modifierArticle connexe
modifierLiens externes
modifier- minoxidil
- Ressources relatives à la santé :
- Notice dans un dictionnaire ou une encyclopédie généraliste :
- http://www.has-sante.fr/portail/jcms/c_1749738/fr/lonoten
Références
modifier- (en) « Minoxidil », sur ChemIDplus.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) British Pharmacopoeia Commission Office, « Safety data sheet according to 1907/2006/EC, Article 31, Minoxidil, Identification of the substance », British Pharmacopoeia Commission Office, (lire en ligne)
- Fiche Sigma-Aldrich du composé Minoxidil≥99%, consultée le 10/4/2011., [PDF] Fiche MSDS
- Min Wu, Qingxiong Yu et Qingfeng Li, « Differences in reproductive toxicology between alopecia drugs: an analysis on adverse events among female and male cases », Oncotarget, vol. 7, no 50, , p. 82074–82084 (ISSN 1949-2553, PMID 27738338, PMCID 5347675, DOI 10.18632/oncotarget.12617, lire en ligne, consulté le )
- (en) Cheng-Lung Hsu,Jai-Shin Liu, An-Chi Lin, Chih-Hsun Yang,Wen-Hung Chung, Wen-Guey Wu, « Minoxidil may suppress androgen receptor-related functions »
- « Pharmacia Merger | Pfizer: One of the world's premier biopharmaceutical companies », sur www.pfizer.com (consulté le )
- Pharmacia
- (en) Norman M. Goldfarb, "Can You Handle the Truth" Journal of Clinical Research Best Practices, Vol. 2, No. 3, March 2006, , 3 p. (lire en ligne)
- Douglas Martin, « Guinter Kahn, Inventor of Baldness Remedy, Dies at 80 », The New York Times, (ISSN 0362-4331, lire en ligne, consulté le )
- (de) Axel Kleemann, Jürgen Engel, Bernd Kutscher et Dietmar Reichert, Pharmaceutical Substances, 4. Auflage (2000), Thieme-Verlag Stuttgart, , 2488 p. (ISBN 978-1-58890-031-9)
- « Minoxidil – Chemie-Schule », sur www.chemie-schule.de (consulté le )
- René Milcent et François Chau, Chimie organique hétérocyclique (Structures fondamentales), EDP Sciences, , 846 p. (ISBN 978-2-7598-0174-9, lire en ligne), p. 634
- Gilmore, E, Weil, J, and Chidsey CA. Treatment of Essential Hypertension with a New Vasodilator in Combination with Beta Adrenergic Blockade, NEJM 282: 521-527, 1970
- Gottlieb, TB, Katz, FH, Chidsey, CA Combined Therapy with Vasodilator Drugs and Beta Adrenergic Blockade, Circulation XLV, 571, 1972
- (Archives médicales nationale Américaines) « Loniten® minoxidil tablets, USP », sur dailymed.nlm.nih.gov (consulté le )
- (en) Peter Conrad, The Medicalization of Society : On the Transformation of Human Conditions into Treatable Disorders, JHU Press, , 224 p. (ISBN 978-0-8018-9234-9 et 0-8018-9234-1, lire en ligne), p. 37
- (en) Will Lester, « Hair-rasing tale: no fame for men who discovered Rogaine », The Daily Gazette, , p. 4 (lire en ligne)
- « History of The Upjohn Company – FundingUniverse », sur www.fundinguniverse.com (consulté le )
- Paula Kepos, International Directory of Company Histories, Vol. 8, St. James Press,
- (en) Harry Wesselt, Orlando Sentinel, « Rogaine: Bald Truth », Chicago Tribune, (lire en ligne)
- « LONITEN® | Pfizer: One of the world's premier biopharmaceutical companies », sur www.pfizer.com (consulté le )
- « LONITEN (comprimés de minoxidil, USP) | Pfizer Canada », sur Pfizer Canada (consulté le )
- « ODDB.org: Open Drug Database | Médicaments | Information destinée au patient », sur oekk.oddb.org (consulté le )
- « Résumé des caractéristiques du produit - LONOTEN 10 mg, comprimé sécable - Base de données publique des médicaments », sur base-donnees-publique.medicaments.gouv.fr (consulté le )
- V.C., « Johnson & Johnson cherche à céder son usine d'Orléans », Les Echos, (lire en ligne)
- « Mens rogaine Unscented Formula (Johnson & Johnson Healthcare Products, Division of McNEIL-PPC, Inc.) Minoxidil 50mg in 1g aerosol, foam », sur www.drugs.com (consulté le )
- HAS - Direction de l'Evaluation Médicale, Economique et de Santé Publique, COMMISSION DE LA TRANSPARENCE Avis 11 juin 2014, (lire en ligne)
- Journal Officiel de la République Française, Modification de l'arrêté du 8 février 1983 modifiant l'arrêté du 21 janvier 1957, (lire en ligne), p. 1886
- « Autorisation REGAINE 2 POUR CENT, solution pour application cutanée », sur agence-prd.ansm.sante.fr (consulté le )
- « Autorisation ALOSTIL 2 POUR CENT, solution pour application cutanée », sur agence-prd.ansm.sante.fr (consulté le )
- « Autorisation MINOXIDIL COOPER 2 %, solution pour application cutanée en flacon », sur agence-prd.ansm.sante.fr (consulté le )
- « Autorisation MINOXIDIL SINCLAIR 2 POUR CENT, solution pour application cutanée en flacon », sur agence-prd.ansm.sante.fr (consulté le )
- « Autorisation MINOXIDIL RPG 2 POUR CENT, solution pour application locale en ampoule », sur agence-prd.ansm.sante.fr (consulté le )
- « Autorisation MINOXIDIL CS 2 POUR CENT, solution pour application cutanée en ampoule », sur agence-prd.ansm.sante.fr (consulté le )
- Journal Officiel de la République Française, Arrêté du 22 février 1990 portant exonération à la réglementation des substances vénéneuses destinées à la médecine humaine, version consolidée au 02 septembre 2016 (lire en ligne)
- Journal Officiel de la République Française, Arrêté du 6 février 2001 fixant la liste des substances qui ne peuvent entrer dans la composition des produits cosmétiques, version consolidée au 02 septembre 2016 (lire en ligne)
- « Autorisation MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée », sur agence-prd.ansm.sante.fr (consulté le )
- « Autorisation MINOXIDIL BAILLEUL 5 %, solution pour application cutanée », sur agence-prd.ansm.sante.fr (consulté le )
- Journal officiel de l’Union européenne, RÈGLEMENT (CE) N°1223/2009 DU PARLEMENT EUROPÉEN ET DU CONSEIL du 30 novembre 2009 relatif aux produits cosmétiques, (lire en ligne)
- JORF, 25 janvier 2012 (lire en ligne)
- « Fiche info - LONOTEN 10 mg, comprimé sécable - Base de données publique des médicaments », sur base-donnees-publique.medicaments.gouv.fr (consulté le )
- « Le Pharmacien - Le référentiel des prix », sur www.lepharmacien.fr (consulté le )
- Pôle documentation de l’Irdes: Marie-Odile Safon, Véronique Suhard, relecture: Sylvain Pichetti, « Historique de la politique du médicament en France », institut de recherche et de documentation en économie de la santé - irdes.fr, , p. 9 (lire en ligne)
- « La lutte contre l'exercice illégal de la pharmacie - Nos missions - Ordre National des Pharmaciens », sur www.ordre.pharmacien.fr (consulté le )
- « Vente de médicaments sur Internet en France », sur Conseil national de l'ordre des pharmaciens, (consulté le )
- « Rechercher un site autorisé pour la vente en ligne de médicaments Ordre National des Pharmaciens », sur www.ordre.pharmacien.fr (consulté le )
- Anne W Lucky, Daniel J Piacquadio, Cherie M Ditre et Frank Dunlap, « A randomized, placebo-controlled trial of 5% and 2% topical minoxidil solutions in the treatment of female pattern hair loss », Journal of the American Academy of Dermatology, vol. 50, no 4, , p. 541–553 (ISSN 0190-9622, DOI 10.1016/j.jaad.2003.06.014, lire en ligne, consulté le )
- Poonkiat Suchonwanit, Sasima Thammarucha et Kanchana Leerunyakul, « Minoxidil and its use in hair disorders: a review », Drug Design, Development and Therapy, vol. 13, , p. 2777–2786 (ISSN 1177-8881, PMID 31496654, PMCID 6691938, DOI 10.2147/DDDT.S214907, lire en ligne, consulté le )
- (en) Rossi A, Cantisani C, Melis L, Iorio A, Scali E, Calvieri S, « Minoxidil use in dermatology, side effects and recent patents », PubMed, (lire en ligne)
- (en) Yuqing Shen, Yuqi Zhu, Li Zhang, Jiayi Sun, Bo Xie, Hongyan Zhang, Xiuzu Song, « New Target for Minoxidil in the Treatment of Androgenetic Alopecia »
- « Minoxidil Response Testing in Males With Androgenetic Alopecia - Full Text View - ClinicalTrials.gov », sur clinicaltrials.gov (consulté le )
- Satoshi Kikuchi, Yuji Fujita, Makoto Onodera et Yasuhisa Fujino, « Prolonged hypotension induced by ingesting a topical minoxidil solution: analysis of minoxidil and its metabolites », Acute Medicine & Surgery, vol. 3, no 4, , p. 384–387 (ISSN 2052-8817, PMID 29123818, PMCID 5667325, DOI 10.1002/ams2.196, lire en ligne, consulté le )
- T.P. Shashikala, Rajeshwar Singh et J. Muthukrishnan, « Refractory shock following ingestion of topical minoxidil solution », Medical Journal, Armed Forces India, vol. 72, no Suppl 1, , S133–S134 (ISSN 0377-1237, PMID 28050093, PMCID 5192187, DOI 10.1016/j.mjafi.2016.02.007, lire en ligne, consulté le )
- (en) Snehangsh Dashcorresponding, VK Sashindran, « Minoxidil Poisoning: A Case of Refractory Shock with Remarkable ECG Changes »
- (en) « Ask a Patient »
- « 15 produits du quotidien mortels à haute dose », sur hitek.fr, (consulté le )
- « LONOTEN », sur VIDAL (consulté le )
- (en) Domenic A. Sica, « Minoxidil: An Underused Vasodilator for Resistant or Severe Hypertension », The Journal of Clinical Hypertension, vol. 6, no 5, , p. 283–287 (ISSN 1524-6175 et 1751-7176, PMID 15133413, PMCID PMC8109604, DOI 10.1111/j.1524-6175.2004.03585.x, lire en ligne, consulté le )
- « ALOPEXY », sur VIDAL (consulté le )
- (en) Poonkiat Suchonwanit,Sasima Thammarucha, Kanchana Leerunyakul, « Minoxidil and its use in hair disorders: a review »
- Fabio Scarinci, Paolo Mezzana, Paola Pasquini et Michelle Colletti, « Central chorioretinopathy associated with topical use of minoxidil 2% for treatment of baldness », Cutaneous and Ocular Toxicology, vol. 31, no 2, , p. 157–159 (ISSN 1556-9535, PMID 21939432, DOI 10.3109/15569527.2011.613427, lire en ligne, consulté le )
- (en) Mohankumar Arthi; Priyankka A; Gautham Supriya D.; Khatri, Manoj; Rajan, Mohan, « Acute Central Serous Chorioretinopathy following Topical Minoxidil use for Androgenic Alopecia »
- (en) Lauren Pickel, Patrick Xiang Ji, Amr Abdelazim, Nirojini Sivachandrancorresponding, « From Hair Loss to Vision Loss: Minoxidil-Associated CRVO in a Young Female »
- (en) F.H.H. LEENEN, D. L. SMITH & W.P. UNGER, « Topical minoxidil:cardiac effects in bald man »,
- (en) « Minoxidil heart muscle », sur Hair Loss Talk


