Aciclovir
L'aciclovir (DCI) ou acyclovir commercialisé sous les noms de Zovirax, Activir ou Aciclovir, est l'un des principaux médicaments antiviraux. Sa découverte a été sentie comme le début d'une nouvelle ère dans la thérapie antivirale, du fait de sa très grande spécificité et de sa faible cytotoxicité. Cependant, l'aciclovir a un champ d'action très restreint, uniquement efficace contre certains virus comme l'HSV-1 et 2, et le VZV, avec une efficacité limitée contre le Virus d'Epstein-Barr (Epstein-Barr virus EBV) actif, et il agit à peine contre la forme humaine du cytomegalovirus (CMV)[3]. Il agit environ 10 fois plus contre l'HSV que contre le VZV. Il ne supprime pas le virus de l'herpès, et n'est pas très efficace contre l'herpès génital chez la femme. L'aciclovir est différent des autres analogues nucléosidiques car il comporte uniquement une structure partielle de nucléoside, le sucre cyclique étant remplacé par une chaîne ouverte.
| Aciclovir | |
| |
| Identification | |
|---|---|
| DCI | acyclovir |
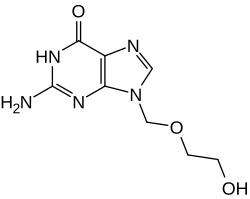
| Nom UICPA | 2-amino-9-((2-hydroxyéthoxy)méthyl) -1H-purin-6(9H)-one |
| Synonymes |
acycloguanosine, aciclovir |
| No CAS | |
| No ECHA | 100.056.059 |
| No CE | 261-685-1 |
| Code ATC | J05 D06 S01 |
| DrugBank | DB00787 |
| PubChem | 2022 7847289 |
| ChEBI | 2453 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C8H11N5O3 [Isomères] |
| Masse molaire[1] | 225,204 6 ± 0,009 1 g/mol C 42,67 %, H 4,92 %, N 31,1 %, O 21,31 %, |
| Précautions | |
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[2] | |
| Données pharmacocinétiques | |
| Biodisponibilité | 10 - 20 % (orale) |
| Liaison protéique | 9 - 33 % |
| Métabolisme | Thymidine kinase virale |
| Demi-vie d’élim. | 2,2 à 20 h |
| Excrétion | |
| Considérations thérapeutiques | |
| Classe thérapeutique | Antiviral antiherpétique |
| Voie d’administration | Orale IV topique |
| Grossesse | Contre-indiquée (car il y a un risque d'avortement pendant les derniers mois de grossesse sauf si nécessaire notamment en cas de zona ophtalmique chez la femme enceinte qui doit être hospitalisée pour bien suivre la grossesse) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Histoire
modifierL'aciclovir a été découvert au milieu des années 1970 par Howard Schaffer (brevet US 4146715 à son nom en 1979), à partir des nucléosides d'une éponge des Caraïbes (Tectitethya ou Cryptotethya ou Tethya crypta)[4], et a été ensuite développé avec la biochimiste, virologue et immunologue américaine Gertrude Elion[5] lauréate du Prix Nobel de médecine en 1988 pour ses découvertes dans l'élaboration de nouveaux médicaments notamment pour le développement de l'aciclovir[6],[7],[8] .
Structure
modifierL'aciclovir (acycloguanosine) est un nucléoside artificiel où le pentose (sucre cyclique, en bleu) de la guanosine (nucléoside naturel) a été remplacé par une structure acyclique constituée d'une chaîne hydrocarburée linéaire (en rose)[9].
Mode d'action
modifierL'aciclovir est converti en forme monophosphate, aciclo-GMP, par la thymidine kinase virale, qui est bien plus efficace (3 000 fois) dans la phosphorylation que la thymidine kinase cellulaire[10]. Ensuite, la forme monophosphate est phosphorylée en forme active triphosphate, aciclo-GTP, par des kinases cellulaires. L'aciclo-GTP est un très puissant inhibiteur de l'ADN polymérase virale ; il a approximativement 100 fois plus d'affinité avec la polymérase virale que la polymérase cellulaire. La forme monophosphate de l'aciclovir agit aussi en s'incorporant dans l'ADN viral durant sa réplication, bloquant la polymérisation de ce dernier (terminateur de chaîne), les enzymes virales ne pouvant pas cliver l'aciclo-GMP de la chaîne de l'ADN. L'aciclo-GTP est très vite métabolisé dans la cellule, probablement par des phosphatases cellulaires[11].
Pharmacocinétique
modifierL'aciclovir est peu soluble dans l'eau, et n'est que partiellement absorbé lors de la prise par voie orale (20 %). Lors de la prise par voie orale, le pic de concentration plasmatique est atteint en 1 à 2 heures. Si de fortes doses sont nécessaires, l'administration doit être faite par voie intraveineuse. L'aciclovir bénéficie d'une haute distribution, seulement 30 % est fixé à des protéines dans le plasma sanguin[12].
La demi-vie du produit est d'environ 3 h. La diffusion tissulaire est bonne et l'élimination est rénale[12].
Pour pallier la faible absorption de l'aciclovir sous forme orale, on utilise actuellement une pro-drogue de l'aciclovir : le valaciclovir.
Le valaciclovir se transforme en aciclovir au niveau de la paroi intestinale. Le valaciclovir (Zelitrex) permet une meilleure observance du traitement et un plus grand confort du malade en permettant une prise par jour là où l'aciclovir (Zovirax) en exige cinq.
L'aciclovir peut aussi être administré localement (pommade) pour le traitement d'infections herpétiques cutanées ou des muqueuses, comme l'herpès génital ou l'herpès labial (bouton de fièvre).
L'administration prophylactique est possible, notamment chez les patients sous immunosuppresseurs ou radiothérapie ou pour les patients souffrant de poussées fréquentes d'herpès labial ou génital.
Métabolisme - Élimination
modifierL'élimination de l'aciclovir se fait via le système rénal, en partie par filtration glomérulaire, et en partie par sécrétion tubulaire.
Des problèmes rénaux ont été rapportés lors de l'administration rapide de fortes doses par voie intraveineuse, ceci à cause de la cristallisation de l'aciclovir dans les néphrons.
Indication
modifierLes infections à HSV (HSV 1 et HSV 2), le zona dans ses formes graves ou en prévention des complications oculaires, la varicelle (chez l'adulte dans les formes graves ou chez l'immunodéprimé, la varicelle du nouveau-né ou de la mère en pré-partum ou post-partum immédiats (dans les cinq jours qui précèdent ou les deux jours qui suivent l'accouchement))[13].
Effets secondaires - Contre-indications
modifierÉtant donné que l'aciclovir peut être incorporé dans l'ADN cellulaire, c'est un mutagène de chromosome, de ce fait, sa prescription doit être évitée chez la femme enceinte. Cependant, il n'a jamais montré d'effet tératogène ou carcinogène[12]. Sa prise doit être évitée par les personnes diabétiques et un faible dosage est recommandé pour celles souffrant de problèmes rénaux.
La LD50 (indicateur quantitatif de toxicité) de l'aciclovir lors de l'administration par voie orale dépasse les 1 mg·kg-1, à cause de la faible absorption par le tractus gastro-intestinal. Des cas isolés ont été rapportés, où des doses extrêmement hautes (jusqu'à 80 mg·kg-1) ont été accidentellement administrées par voie intraveineuse, sans causer d'effets secondaires.
Les effets indésirables les plus courants sont une irritation locale ou une sensation de piqûre ou de brûlure au niveau de la zone d'application de la pommade, et des céphalées lors de la prise par voie orale.
La résistance à l'aciclovir évolue assez rapidement, bien que ceci ne gêne pas son utilisation clinique. Les formes résistantes sont le plus souvent des virus ayant subi une mutation de leur thymidine kinase ou de leur ADN polymérase[14].
Indications
modifierLes principales indications sont[3] :
- Herpès labial (et prophylaxie)
- Herpès génital (et prophylaxie)
- Kératite herpétique
- Encéphalite herpétique
- Herpès zoster (Zona)
- Varicelle
Divers
modifierL’aciclovir fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en )[15].
En France, les formes topiques (pommades) à base d'aciclovir sont radiées de la liste des médicaments remboursables aux assurés sociaux en vertu de l'arrêté du [16], ainsi que de la liste des médicaments agréés à l'usage des collectivités publiques[17] en raison du Service Médical Rendu (SMR) insuffisant.
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur monographs.iarc.fr, CIRC, (consulté le ).
- (en) « Acyclovir (Systemic) », Nucleosides and Nucleotides, sur www.drugs.com, Drugs.com, (consulté le ).
- (en) M. S. Laport et O. C. S. Santos and G. Muricy, « Marine Sponges: Potential Sources of New Antimicrobial Drugs », Current Pharmaceutical Biotechnology, (DOI 10.2174/138920109787048625, lire en ligne, consulté le ).
- (en) G. B. Elion, P. A. Furman, J. A. Fyfe et P. d. Miranda, « Selectivity of action of an antiherpetic agent, 9-(2-hydroxyethoxymethyl)guanine », Proceedings of the National Academy of Sciences, vol. 74, no 12, , p. 5716–5720 (ISSN 0027-8424 et 1091-6490, PMID 202961, PMCID PMC431864, DOI 10.1073/pnas.74.12.5716, lire en ligne, consulté le )
- (en-US) « The Nobel Prize in Physiology or Medicine 1988 », sur NobelPrize.org (consulté le ).
- (en-US) « Meet the woman who gave the world antiviral drugs », sur Science, (consulté le ).
- (en-US) Richard Kent et Brian Huber, « Gertrude Belle Elion (1918-99) », Nature, vol. 398, no 6726, , p. 380–380 (ISSN 1476-4687, DOI 10.1038/18790, lire en ligne, consulté le )
- (en) Kurt Eger, Eberhard M. Kluender et Mathias Schmidt, « Synthesis of New Acyclic Pyrimidine Nucleoside Analogs as Potential Antiviral Drugs », Journal of Medicinal Chemistry, vol. 37, no 19, , p. 3057–3061 (ISSN 0022-2623 et 1520-4804, DOI 10.1021/jm00045a010, lire en ligne, consulté le )
- « Acyclovir capsules and tablets - Rx only », sur dailymed.nlm.nih.gov (consulté le ).
- (en) G. B. Elion, « Acyclovir: Discovery, mechanism of action, and selectivity », Journal of Medical Virology, vol. 41, no S1, , p. 2–6 (DOI 10.1002/jmv.1890410503, lire en ligne, consulté le )
- (en) « Aciclovir Tablets BP 400mg - Summary of Product Characteristics (SmPC) - (emc) », sur www.medicines.org.uk (consulté le ).
- Commission de Transparence de la HAS, « ACICLOVIR G GAM 250 mg, poudre pour solution pour perfusion, flacon (B/1- B/5) », Avis de la HAS, (lire en ligne)
- (en) Jocelyne Piret et Guy Boivin, « Resistance of Herpes Simplex Viruses to Nucleoside Analogues: Mechanisms, Prevalence, and Management », Antimicrobial Agents and Chemotherapy, vol. 55, no 2, , p. 459–472 (ISSN 0066-4804 et 1098-6596, PMID 21078929, PMCID PMC3028810, DOI 10.1128/AAC.00615-10, lire en ligne, consulté le )
- WHO Model List of Essential Medicines, 18th list, avril 2013.
- https://www.legifrance.gouv.fr/eli/arrete/2019/3/12/SSAS1902207A/jo/texte
- https://www.legifrance.gouv.fr/eli/arrete/2019/3/12/SSAS1902208A/jo/texte
Lien externe
modifierBibliographie
modifier- (en) Harvey Stewart C. in « Remington’s Pharmaceutical Sciences 18th edition » : (ed. Gennard, Alfonso R.) Mack Publishing Company, 1990, (ISBN 978-0-912734-04-0).
- Huovinen P., Valtonen V. in « Kliininen Farmakologia » (ed. Neuvonen et. al.), Kandidaattikustannus Oy, 1994 (ISBN 978-951-8951-09-7).
- (en) Périgaud C., Gosselin G., Imbach J. -L. « Nucleoside analogues as chemotherapeutic agents: a review » Nucleosides and nucleotides 1992, 11(2-4)
- (en) Rang H.P., Dale M.M., Ritter J.M.: « Pharmacology, 3rd edition », Pearson Professional Ltd, 1995, 2003 (5th) edition (ISBN 978-0-443-07145-4) ; 2001 (4th) edition (ISBN 978-0-443-06574-3) ; 1990 edition (ISBN 978-0-443-03407-7).
Lien externe
modifierCompendium suisse des médicaments : spécialités contenant Aciclovir