Oxyde de vanadium(III)
Le sesquioxyde de vanadium ou oxyde de vanadium(III) est un composé inorganique de formule V2O3. C'est un membre de la famille des oxydes de vanadium, constitués d'oxygène et de vanadium. V2O3 présente une transition très brutale d'un état métallique vers un état isolant autour de la température de 150 K. Il est considéré comme un matériau "prototype" pour la transition de Mott[6]. Durant cette transition, la résistivité du matériau chute de 7 ordres de grandeur[7].
Les premiers travaux publiés sur les propriétés thermodynamiques de ce composé datent de 1936 avec T. Anderson[8]; ceux-ci révèlent une "anomalie" dans le comportement de la chaleur spécifique du matériau autour de la température de transition. Par la suite, M. Foëx, en 1946, mettra en évidence la transition des propriétés électriques[9].
| Sesquioxyde de vanadium | |||
| |||
| __ V3+ __ O2− | |||
| Identification | |||
|---|---|---|---|
| DCI | Sesquioxyde de vanadium | ||
| Nom UICPA | oxo(oxovanadiooxy)vanadium[1] | ||
| Synonymes |
|
||
| No CAS | |||
| No ECHA | 100.013.847 | ||
| No CE | 215-230-9 | ||
| No RTECS | YW3050000 | ||
| PubChem | 518710 | ||
| SMILES | |||
| InChI | |||
| Apparence | poudre noire[2] solide cristallin noir[1] |
||
| Propriétés chimiques | |||
| Formule | V2O3 | ||
| Masse molaire[3] | 149,881 2 ± 0,001 1 g/mol O 32,02 %, V 67,98 %, |
||
| Propriétés physiques | |||
| T° fusion | 1 957 °C[2] 1 970 °C[1],[4],[5] |
||
| T° ébullition | environ 3 000 °C[2],[4] | ||
| Solubilité | eau : très peu, 100 mg·l-1[5] à 20 °C[1] 138 mg·l-1 à 21 °C[4] |
||
| Masse volumique | 4,87 g cm−3[1],[2] à 25 °C[4],[5] | ||
| T° d'auto-inflammation | non inflammable | ||
| Précautions | |||
| SGH[1],[4] | |||
| H315, H319, H332, H335, P261, P264, P271, P280, P312, P321, P362, P302+P352, P304+P312, P304+P340, P305+P351+P338, P332+P313, P337+P313, P405, P403+P233 et P501 |
|||
| Transport[1] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 5 639 mg/kg (rat, oral)[4] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Synthèse
modifierL'oxyde de vanadium(III) peut être obtenu par la réduction de l'oxyde de vanadium(V), V2O5 avec de l'hydrogène, H2 ou du monoxyde de carbone, CO[10] :
Structure
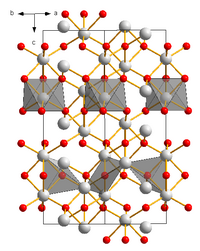
modifierA température ambiante, le V2O3 cristallise dans une structure équivalente à celle de l'alumine α (ou corindon) avec une symétrie rhomboédrique, groupe d'espace R3c (no 167) avec comme paramètres de maille, a = 495,2 pm, c = 1400,3 pm[10]. Quand la température descend en dessous de 150K, le matériau subit une modification de structure et la symétrie devient monoclinique, groupe d'espace I2/a (no 15).
Références
modifier- PubChem CID 518710
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, vol. 97, CRC Press/Taylor and Francis, , 2652 p. (ISBN 978-1-4987-5428-6 et 1-4987-5428-7), « Physical Constants of Inorganic Compounds », p. 813 (4-94).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Vanadium(III) oxide 99.99% trace metals basis, consultée le 8 août 2017. + (pdf) Fiche MSDS
- Entrée « Vanadium(III)-oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 6 août 2017 (JavaScript nécessaire).
- (en) S. Lupi, L. Baldassarre, B. Mansart, A. Perucchi, A. Barinov, P. Dudin, E. Papalazarou, F. Rodolakis, J. -P. Rueff, J. -P. Itié, S. Ravy, D. Nicoletti et P. Postorino, « A microscopic view on the Mott transition in chromium-doped V2O3 », Nat. Com., no 1, , p. 1 (lire en ligne)
- (en) Gilbert Goodman, « Electrical Conductivity Anomaly in Vanadium Sesquioxide », Phys. Rev. Lett., no 9, , p. 305 (lire en ligne)
- (en) T. Anderson, « The Heat Capacities of Vanadium, Vanadium Trioxide, Vanadium Tetroxide and Vanadium Pentoxide at Low Temperatures », J. Am. Chem. Soc., no 58, , p. 564 (lire en ligne)
- Marc Foëx, « Etude dilatométrique et électrique de l'anomalie, présentée à basse température, par le sesquioxyde de vanadium », Comptes rendus hebdomadaires des séances de l'Académie des Sciences, , p. 1126 (lire en ligne)
- (de) Georg Brauer, Handbuch der präparativen anorganischen Chemie, 1981, Enke, Stuttgart, p. 1419. (ISBN 3-432-87823-0).

