Processus isotherme
Un processus isotherme est en thermodynamique une transformation chimique ou physique d'un système au cours de laquelle la température du système est constante et uniforme.

Description
modifierPour assurer l'invariance de la température, il doit y avoir transfert de chaleur, ou énergie thermique, entre le système et l'extérieur. Un transfert de chaleur est proportionnel à la différence de température, il s'arrête naturellement quand les températures sont égales. Si une barrière isolante freine les transferts de chaleur, on constate une différence de température qui dure un certain temps. Pour que la différence de température reste nulle, le transfert de chaleur nécessaire pour combler cette différence doit être immédiat, sans aucun frein. Autrement dit, la variation de température reste nulle (ΔT = 0) si et seulement si la chaleur échangée entre le système et l'extérieur est maximale.
La quantité de chaleur transférée peut être nulle si le processus observé n'engendre pas de différence de température. Le processus isotherme est caractérisé par la liberté du flux de l'énergie thermique, l'absence de frein, de résistance ou d'isolant.
Au cours d'un processus isotherme la température du système est constante, ce qui implique que la transformation est quasistatique et réversible. Un processus isotherme diffère d'un processus monotherme dans lequel la température est également identique en début et fin de transformation mais peut varier au cours de celle-ci.
Application aux gaz parfaits
modifierDans le cas d'un gaz parfait :
où :
- est la pression du gaz (en pascals) ;
- est le volume occupé par le gaz (en mètres cubes) ;
- est la quantité de matière (en moles) ;
- est la constante universelle des gaz parfaits (en joules par mole et par kelvin) ;
- est la température absolue (en kelvins).
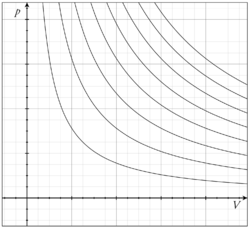
Ceci correspond à une famille de courbes à température constante qui peuvent être tracées sur un diagramme thermodynamique pV, ou diagramme de Clapeyron. Un tel graphique fut utilisé pour la première fois par James Watt pour connaître l'efficacité des moteurs à vapeur. Chaque courbe correspond à une température donnée.
Le calcul du travail en thermodynamique correspond au changement d'énergie potentielle entre l'état en et celui en :
Pour un processus isotherme réversible, ceci correspond à l'intégrale de l'aire sous la ligne isotherme représentée par une température donnée dans le diagramme précédent :
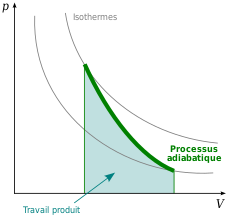
Comparaison du travail entre processus isotherme et processus adiabatique
modifierLe processus adiabatique est pris comme référence théorique idéale, qui montre le comportement sans perte thermique, ce qui se traduit numériquement par une efficacité énergétique de 100 % exactement.
Le travail nécessaire à une compression isotherme est plus grand que le travail nécessaire à la même compression adiabatique. Dans le cas adiabatique le gaz est réchauffé par la compression et sa température finale est plus élevée que sa température initiale. Dans le cas isotherme on laisse la chaleur sortir du système : le supplément de travail observé par rapport à la compression adiabatique correspond à la chaleur perdue par le système. On en déduit que l'efficacité énergétique théorique d'une compression isotherme est inférieure à 100 %, ce que l'on retrouve par exemple dans l'étude du cycle de Carnot.
Le travail issu d'une détente isotherme est plus grand que le travail issu de la même détente adiabatique. Dans le cas adiabatique le gaz est refroidi par la détente et sa température finale est plus basse que sa température initiale. Dans le cas isotherme on laisse la chaleur entrer dans le système : le supplément de travail observé par rapport à la détente adiabatique correspond à la chaleur gagnée par le système. On en déduit que l'efficacité énergétique théorique d'une détente isotherme est supérieure à 100 %, ce que l'on retrouve par exemple dans l'étude d'une machine frigorifique.
Applications
modifierLe processus isotherme intervient dans diverses applications techniques et biologiques :
- dans un moteur thermique, deux parties du cycle de Carnot sont isothermes ;
- les transitions de phase (fusion, vaporisation, condensation, etc.) sont isothermes.