Mésembrine
La mésembrine est un alcaloïde indolique présent dans de nombreuses plantes de la famille des Aizoaceae comme Mesembryanthemum crystallinum[2] et Sceletium tortuosum (Kanna)[3], toutes deux originaires d'Afrique du Sud.
| Mésembrine | |
  |
|
| Identification | |
|---|---|
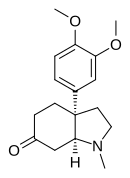
| Nom UICPA | (3aS,7aS)-3a-(3,4-diméthoxyphényl)-1-méthyloctahydro-6H-indol-6-one |
| No CAS | [(+)-(3aR,7aR)] [(–)-(3aS,7aS)] |
| PubChem | 193296 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C17H23NO3 [Isomères] |
| Masse molaire[1] | 289,369 4 ± 0,016 3 g/mol C 70,56 %, H 8,01 %, N 4,84 %, O 16,59 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|

Stéréochimie
modifierLa mésembrine a d'abord été isolée et caractérisée par K. Bodendorf et W. Krieger en 1957[4]. La mésembrine est une molécule bicyclique et possède deux atomes de carbone chiraux en tête du pont entre le cycle à cinq chaînons et le cycle à six chaînons. Des contraintes stériques ne permettent l'existence que d'une paire d'énantiomères : la (+)-(3aR,7aR)-mésembrine et la (–)-(3aS,7aS)-mésembrine. Les descripteurs de chiralité aR et aS dans cette molécule ne réfèrent pas à une chiralité axiale mais correspondent au système de numérotation des atomes qui assigne un « a » aux atomes de la partie indolique de la molécule comme le montre le numéro de branchement -3a- du groupe 3,4-diméthoxyphényle sur cette partie. L'isomère lévogyre, la (−)-mésembrine, constitue la forme naturelle[5],[6]. De fait, ceci a été déterminé en 1970 en résolvant la structure cristalline du dérivé méthiodure de 6-epimésembranol qui est monoclinique, groupe d'espace P21 (no 4)[5].
Propriété
modifierEn médecine traditionnelle, une propriété antidépressive est attribuée à cet alcaloïde [7]. On observe chez le rat une inhibition de la recapture de la sérotonine accompagnée d'une ataxie : ce deuxième effet pourrait en limiter le potentiel thérapeutique [8] bien que l'alcaloïde semble présenter une faible toxicité in vivo [9]. La mésembrine est aussi un inhibiteur de la phosphodiestérase[10].
Synthèse totale
modifierEn raison de sa structure et de sa bioactivité, la mésembrine a été une cible via une synthèse totale depuis les années 1970. Plus de quarante synthèses totales ont été rapportées pour la mésembrine, dont la plupart portent sur différentes approches et stratégies pour la construction du système bicyclique et de l'atome de carbone quaternaire.
La première synthèse totale de la mésembrine a été rapportée par Maurice Shamma et Herman R. Rodriguez en 1965[11]. Cette voie de synthèse a vingt et une étapes, ce qui la place parmi les plus longues pour la mésembrine. Les principales étapes comprennent la construction du cycle à six chaînons avec une cétone par réaction de Diels-Alder, une α-allylation pour la synthèse du carbone quaternaire et une réaction d'addition conjuguée pour la fermeture finale du cycle à cinq chaînons. Le produit final de cette voie de synthèse est le mélange racémique de (+)- et (–)-mésembrine :
Rétrosynthèse totale de Shanna de la (±)-mésembrine
En 1971, Shun-ichi Yamada a rapporté la première synthèse totale asymétrique de la (+)-mésembrine. Le carbone quaternaire est introduit par une annélation de Robinson asymétrique promu par un dérivé L-proline[12].
Sources
modifier- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Mesembrine » (voir la liste des auteurs) et en allemand « Mesembrin » (voir la liste des auteurs)..
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- J.S. Glasby, ((Directory Of Plants Containing Secondary Metabolites, Taylor & Francis, London, New York, 1991, p. 780. (ISBN 978-0-85066-423-2).
- M. T. Smith, N. R. Crouch, N. Gericke, M. Hirst, Psychoactive constituents of the genus Sceletium N.E.Br. and other Mesembryanthemaceae: A Review, Journal of Ethnopharmacology, 1996, vol. 50(3), pp. 119–130. DOI 10.1016/0378-8741(95)01342-3, .
- K. Bodendorf, W. Krieger, , Arch. Pharm., 1957, vol. 290, pp. 441-448
- P. Coggon, D.S. Farrier, P.W. Jeffs, A.T. McPhail, Absolute configuration of mesembrine and related alkaloids: X-ray analysis of 6-epimesembranol methiodide., J. Chem. Soc. B, 1970, pp. 1267–1271. DOI 10.1039/J29700001267.
- Peter W. Jeffs, Richard L. Hawks, D. S. Farrier, Structure of the mesembranols and the absolute configuration of mesembrine and related alkaloids, J. Am. Chem. Soc., 1969, vol. 91(14), pp 3831–3839. DOI 10.1021/ja01042a025.
- G. I. Stafford, M. E. Pedersen, J. van Staden, A. K. Jäger, Review on plants with CNS-effects used in traditional South African medicine against mental diseases, Journal of Ethnopharmacology, 2008, vol. 119(3), pp. 513–537. DOI 10.1016/j.jep.2008.08.010, .
- M.J. Loria, Z. Ali et al., Effects of Sceletium tortuosum in rats, J Ethnopharmacol., 2014, vol. 155, pp. 731–735. DOI 10.1016/j.jep.2014.06.007,
- A toxicological safety assessment of a standardized extract of Sceletium tortuosum (Zembrin(®)) in rats, Food Chem Toxicol., 2014, vol. 74, pp. 190–199. DOI 10.1016/j.fct.2014.09.017, .
- A. L. Harvey, L. C. Young, A. M. Viljoen, N. P. Gericke, Pharmacological actions of the South African medicinal and functional food plant Sceletium tortuosum and its principal alkaloids, Journal of Ethnopharmacology, 2011, vol. 137(3), pp. 1124–1129. DOI 10.1016/j.jep.2011.07.035, .
- Maurice Shamma, Herman R. Rodriguez, The total synthesis of (±)-mesembrine, Tetrahedron Lett., 1965, vol. 6(52), p. 4847-4851. DOI 10.1016/S0040-4039(01)89046-8.
- Shun-ichi Yamada, Total synthesis of (+)-mesembrine by asymmetric synthesis with amino acid, Tetrahedron Lett., 1971, vol. 12(16), pp. 1133-1136. DOI 10.1016/S0040-4039(01)96647-X.