Acétoacétate d'éthyle
L'acétoacétate d'éthyle est l'ester éthylique de l'acide acétylacétique.
| Acétoacétate d'éthyle | |||
| |||
 | |||
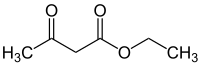
| Représentations plane et 3D de l'acétoacétate d'éthyle. | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 3-oxobutanoate d'éthyle | ||
| Synonymes |
3-oxobutyrate d'éthyle |
||
| No CAS | |||
| No ECHA | 100.005.015 | ||
| No CE | 205-516-1 | ||
| No RTECS | AK5250000 | ||
| PubChem | 8868 | ||
| ChEBI | 4893 | ||
| FEMA | 2415 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, odeur de rhum, fruitée[1] | ||
| Propriétés chimiques | |||
| Formule | C6H10O3 [Isomères] |
||
| Masse molaire[2] | 130,141 8 ± 0,006 4 g/mol C 55,37 %, H 7,74 %, O 36,88 %, |
||
| pKa | 10,68 (eau) ; 14,2 (DMSO)[réf. souhaitée] | ||
| Propriétés physiques | |||
| T° fusion | −45 °C[1] | ||
| T° ébullition | 180,8 °C[1] | ||
| Solubilité | 111 g l−1 (eau, 17 °C), soluble dans le benzène et le chloroforme[1] | ||
| Paramètre de solubilité δ | 20,1 J1/2 cm−3/2 (25 °C)[3] | ||
| Miscibilité | miscible avec l'éther et l'acétone[1] | ||
| Masse volumique | 1,03 g cm−3 à 20 °C[4] | ||
| T° d'auto-inflammation | 304 °C[4] | ||
| Point d’éclair | 84 °C[1] | ||
| Limites d’explosivité dans l’air | 9,5 %[4] | ||
| Pression de vapeur saturante | 0,78 mmHg (25 °C)[1] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,418-1,421[4] | ||
| Précautions | |||
| SGH | |||
| Transport | |||
|
|||
| Écotoxicologie | |||
| DL50 | 3,98 g kg−1 (rat, oral) >10 ml kg−1 (lapin, dermal)[1] |
||
| Données pharmacocinétiques | |||
| Stockage | séparer des oxydants | ||
| Composés apparentés | |||
| Autres composés | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Synthèse
modifierCe composé est synthétisé par Johann Georg Anton Geuther pour la première fois en 1863[5].
Il est maintenant produit industriellement à partir de dicétène et d'éthanol, en présence d'acide sulfurique ou de triéthylamine avec de l'acétate de sodium.
Il est également synthétisé en laboratoire par une condensation de Claisen de l'acétate d'éthyle, en présence d'éthanolate de sodium. Cette synthèse a été présentée pour la première fois par Johannes Wislicenus.
Propriétés
modifierL'acétoacétate d'éthyle est un liquide huileux incolore, d'odeur agréable. Il est naturellement présent dans les fraises[1].
Le groupe méthylène activé entre les deux groupes carbonyle est très réactif.
Il est sujet à la tautomérie cétone-énol à la température ambiante, consistant en environ 93 % de forme cétonique et 7 % de forme énolique[1].
Il est acide (pKa = 10,68) car l'anion énolate est fortement stabilisé par la mésomérie.
Utilisations
modifierCe composé 1-3 dicarbonylé est utilisé comme intermédiaire pour synthétiser de nombreux produits tels que pigments jaunes pour peintures, laques, encres, colorants, acides aminés, méthionine, antipaludéens (Atabrine), thiamine (vitamine B1), analgésiques, phénazone et aminophénazone[1]. Il est aussi utilisé en tant que solvant et arôme alimentaire.
C'est un réactif pouvant servir en colorimétrie : en présence de chlorure de fer(III), il forme un complexe de coordination violet. La réaction est cependant non spécifique.
Notes et références
modifier- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Ethyl acetoacetate » (voir la liste des auteurs) et en allemand « Acetessigester » (voir la liste des auteurs).
- (en) « Ethyl acetoacetate » dans la base de données Hazardous Substances Data Bank (consulté le 21 mars 2014).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- (en + fr) Fiche Sigma-Aldrich du composé Ethyl acetoacetate, consultée le 9 septembre 2012.
- Pierre de Menten, Dictionnaire de chimie : Une approche étymologique et historique, De Boeck, , 395 p. (ISBN 978-2-8041-8175-8, lire en ligne), p. 18.

