Titanate de lithium
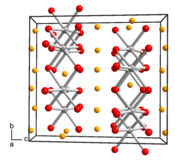
Le titanate de lithium est un composé chimique de formule Li2TiO3. Il se présente comme un solide blanc cristallisé fondant entre 1 520 et 1 564 °C et dont la masse volumique à température ambiante vaut 3,43 g/cm3. Il s'agit d'une céramique dont la phase la plus stable, notée β-Li2TiO3, cristallise dans le système monoclinique[3] avec le groupe d'espace C2/c (no 15) et les paramètres cristallins a = 504,1 pm, b = 880,6 pm, c = 972,6 pm et β = 100,0°[4]. Cette structure cristalline se compose de couches d'octaèdres TiO6 partageant leurs arêtes, les cations de lithium Li+ étant incorporés à la fois au sein de ces couches et entre deux couches contiguës. Une phase cubique se forme réversiblement au-dessus de températures de l'ordre de 1 150 à 1 250 °C ; notée γ-Li2TiO3, elle se comporte comme une solution solide[5]. À températures plus basses, il existe une phase cubique métastable notée α-Li2TiO3, isostructurelle avec la phase γ-Li2TiO3, qui se convertit en phase β à 400 °C[6]. On peut trouver du titanate de lithium dans le commerce à température ambiante sous la forme d'une poudre blanche.
| Titanate de lithium | ||
| ||
 | ||
| __ Li+ __ Ti4+ __ O2− Structure cristalline du titanate de lithium |
||
| Identification | ||
|---|---|---|
| Synonymes |
métatitanate de lithium |
|
| No CAS | ||
| No ECHA | 100.031.586 | |
| No CE | 234-759-6 | |
| PubChem | 160968 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | Li2TiO3 | |
| Masse molaire[1] | 109,747 ± 0,006 g/mol Li 12,65 %, O 43,74 %, Ti 43,62 %, |
|
| Propriétés physiques | ||
| T° fusion | 1 520 à 1 564 °C[2] | |
| Masse volumique | 3,43 g·cm-3[2] | |
| Cristallographie | ||
| Système cristallin | Monoclinique | |
| Symbole de Pearson | ||
| Classe cristalline ou groupe d’espace | C2/c (no 15) |
|
| Paramètres de maille | a = 504,1 pm, b = 880,6 pm, c = 972,6 pm, β = 100,0° | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
On prépare le Li2TiO3 généralement à partir d'un mélange de carbonate de lithium Li2CO3, de nitrate de titane (en) Ti(NO3)4 et d'acide citrique traité par calcination, compaction et frittage. Le matériau nanocristallin obtenu peut être utilisé comme précurseur en raison de sa grande pureté[7].
Le titanate de lithium peut être utilisé comme cathode de pile à combustible à carbonate fondu et de certains accumulateurs lithium-ion. Dans ces derniers, le titanate de lithium stabilise les conducteurs cathodiques LiMO2, où M représente un métal comme le fer, le manganèse, le chrome ou le nickel, qui forment des couches avec le Li2TiO3 pour permettre la diffusion du lithium. Le titanate de lithium peut également être utilisé sous forme de nanocristaux à la surface de l'anode des accumulateurs au titanate de lithium à la place du carbone des accumulateurs lithium-ion, ce qui accroît considérablement la surface spécifique à l'anode et permet un chargement plus rapide au détriment de la densité massique d'énergie de l'accumulateur.
Le lithium 6 étant un isotope susceptible de produire du tritium par absorption de neutrons thermiques, des galets céramiques constitués de titanate de lithium Li2TiO3 et d'orthosilicate de lithium Li4SiO4 sont des matériaux étudiés notamment dans le réacteur thermonucléaire expérimental international ITER[8] pour réutiliser les neutrons thermiques quittant le plasma afin de produire du tritium susceptible de poursuivre la réaction de fusion nucléaire tout en libérant 4,8 MeV par noyau de tritium formé :
Notes et références modifier
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Lithium Titanate », sur americanelements.com (consulté le ).
- (en) M. Vijayakumar, Sebastien Kerisit, Zhenguo Yang, Gordon L. Graff, Jun Liu, Jesse A. Sears, Sarah D. Burton, Kevin M. Rosso et Jianzhi Hu, « Combined 6,7Li NMR and Molecular Dynamics Study of Li Diffusion in Li2TiO3 », The Journal of Physical Chemistry, vol. 113, no 46, , p. 20108-20116 (DOI 10.1021/jp9072125, lire en ligne)
- (en) J. F. Dorrian et R. E. Newnham, « Refinement of the structure of Li2TiO3 », Materials Research Bulletin, vol. 4, no 3, , p. 179-183 (DOI 10.1016/0025-5408(69)90054-3, lire en ligne)
- (en) H. Kleykamp, « Phase equilibria in the Li–Ti–O system and physical properties of Li2TiO3 », Fusion Engineering and Design, vol. 61-62, , p. 361-366 (DOI 10.1016/S0920-3796(02)00120-5, lire en ligne)
- (en) Andreas Laumann, Kirsten Marie Ørnsbjerg Jensen, Christoffer Tyrsted, Martin Bremholm, Karl Thomas Fehr, Michael Holzapfel et Bo Brummerstedt Iversen, « In‐situ Synchrotron X‐ray Diffraction Study of the Formation of Cubic Li2TiO3 Under Hydrothermal Conditions », European Journal of Inorganic Chemistry, vol. 2011, no 14, , p. 2221-2226 (DOI 10.1002/ejic.201001133, lire en ligne)
- (en) A. Shrivastava, M. Makwana, P. Chaudhuri et E. Rajendrakumar, « Preparation and Characterization of the Lithium Metatitanate Ceramics by Solution-Combustion Method for Indian LLCB TBM », Fusion Science and Technology, vol. 65, no 2, , p. 319-324 (DOI 10.13182/FST13-658, lire en ligne)
- (en) Dorian A. H. Hanaor, Matthias H. H. Kolb, Yixiang Gan, Marc Kamlah et Regina Knitter, « Solution based synthesis of mixed-phase materials in the Li2TiO3–Li4SiO4 system », Journal of Nuclear Materials, vol. 456, , p. 151-161 (DOI 10.1016/j.jnucmat.2014.09.028, Bibcode 2015JNuM..456..151H, arXiv 1410.7128, lire en ligne)



