Tétraphénylporphyrine
La tétraphénylporphyrine (TPP, H2TPP) est un composé hétérocyclique synthétique appartenant à la famille des porphyrines. Les porphyrines sont des pigments et des cofacteurs présents dans l'hémoglobine et les cytochromes et sont apparentées aux chlorophylles et à la vitamine B12. L'étude des porphyrines naturelles est rendue difficile par leur faible degré de symétrie et la présence de substituants polaires. La tétraphénylporphyrine, quant à elle, est hydrophobe, symétrique du point de vue de ses substituants, et simple à produire. Il s'agit d'un solide noir violacé soluble dans les solvants organiques apolaires tels que le chloroforme et le benzène.
| Tétraphénylporphyrine | |
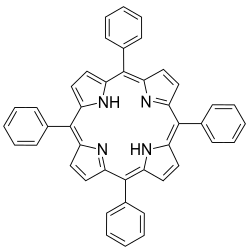
| |
| Structure de la tétraphénylporphyrine | |
| Identification | |
|---|---|
| Nom UICPA | 5,10,15,20-tétraphénylporphyrine |
| Synonymes |
méso-Tétraphénylporphine |
| No CAS | |
| No ECHA | 100.011.842 |
| PubChem | 70186 |
| ChEBI | 52279 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C44H30N4 [Isomères] |
| Masse molaire[1] | 614,735 8 ± 0,038 1 g/mol C 85,97 %, H 4,92 %, N 9,11 %, |
| Propriétés physiques | |
| T° fusion | > 300 °C[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Production et structure
modifierLa tétraphénylporphyrine a été synthétisée pour la première fois en 1935 par réaction du benzaldéhyde sur du pyrrole dans un tube scellé à 150 °C pendant 24 heures[3]. Le procédé a ensuite été modifié pour permettre au benzaldéhyde de réagir avec le pyrrole pendant 30 minutes dans un reflux d'acide propionique à 141 °C à l'air libre[4] :
En dépit de son faible rendement, la synthèse de la tétraphénylporphyrine est une expérience courant dans les laboratoires universitaires[5].
La base conjuguée de la porphyrine, TPP2−, appartient au groupe de symétrie D4h, tandis que la porphyrine elle-même H2TPP est D2h. Contrairement aux porphyrines naturelles, la tétraphénylporphyrine est substituée sur les atomes de carbone méso, d'où son nom de méso-tétraphénylporphine. Il existe une autre porphyrine synthétique possédant une structure biomimétique : l'octaéthylporphyrine, H2OEP. On connaît de nombreux dérivés du H2TPP et du H2OEP, comprenant également ceux préparés à partir de benzaldéhydes substitués. L'un des premiers analogues fonctionnels de la myoglobine a été le dérivé ferreux de la « porphyrine à palissade », structurellement apparentée au Fe(TPP), obtenu à partir de la condensation de 2-nitrobenzaldéhyde et de pyrrole.
-
Exemple de porphyrine à palissade complexée avec du fer, les sites de coordination axiaux étant occupés par la méthylimidazole (en vert) et l'oxygène.
Les dérivés sulfonés de la tétraphénylporphyrine donnent également des dérivés solubles dans l'eau, comme la tétraphénylporphine sulfonate :
- 4 SO3 + (C6H5C)4(C4H2N)2(C4H2NH)2 → (HO3SC6H4C)4(C4H2N)2(C4H2NH)2 + 4 H2O.
Propriétés optiques et applications
modifierLa tétraphénylporphyrine possède une forte bande d'absorption avec un maximum à 419 nm (bande de Soret) et quatre bandes plus faibles avec des maxima à 515 nm, 550 nm, 593 nm et 649 nm (bandes Q). Elle présente une fluorescence rouge avec des maxima à 649 nm et 717 nm. Le rendement quantique est de 11 %[6].
H2TPP est un composé photosensible permettant de produire de l'oxygène singulet[7]. Il a par ailleurs un potentiel d'utilisation en électronique moléculaire dans la mesure où ses molécules présentent un comportement proche des diodes qui peut être contrôlé pour chaque molécule individuellement[8].
-
Propriétés optiques de la tétraphénylporphyrine dans le toluène.
-
Observation au microscope à effet tunnel (a) de l'application d'un voltage excessif (b) à une molécule de H2TPP (c) au niveau de point noir indiqué en d, conduisant au TPP2− (e).
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé 5,10,15,20-Tetraphenyl-21H,23H-porphine ≥99%, consultée le 29 octobre 2016.
- (en) Paul Rothemund, « A New Porphyrin Synthesis. The Synthesis of Porphin », Journal of the American Chemical Society, vol. 58, no 4, , p. 625-627 (DOI 10.1021/ja01295a027, lire en ligne)
- (en) Alan D. Adler, Frederick R. Longo, John D. Finarelli, Joel Goldmacher, Jacques Assour et Leonard Korsakoff, « A simplified synthesis for meso-tetraphenylporphine », The Journal of Organic Chemistry, vol. 32, no 2, , p. 476-476 (DOI 10.1021/jo01288a053, lire en ligne)
- (en) Diane F. Marsh, « Microscale Synthesis and 1H NMR Analysis of Tetraphenylporphyrins », Journal of Chemical Education, vol. 76, no 2, , p. 237 (DOI 10.1021/ed076p237, lire en ligne)
- (en) Jean B. Kim, John J. Leonard et Frederick R. Longo, « Mechanistic study of the synthesis and spectral properties of meso-tetraarylporphyrins », Journal of the American Chemical Society, vol. 94, no 11, , p. 3986-3992 (PMID 5037983, DOI 10.1021/ja00766a056, lire en ligne)
- (en) Karl-Heinz Pfoertner, « Photochemistry », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a19_573, lire en ligne)
- (en) Vinícius Claudio Zoldan, Ricardo Faccio et André Avelino Pasa, « n and p type character of single molecule diodes », Scientific Reports, vol. 5http://www.nature.com/articles/srep08350, , article no 8350 (PMID 25666850, PMCID 4322354, DOI 10.1038/srep08350)