Tétracarbonylferrate de disodium
Le tétracarbonylferrate de disodium est un composé organofer de formule Na2[Fe(CO)4]. Il est utilisé en solution, par exemple dans le tétrahydrofurane ou le diméthoxyéthane, qui se lient au cation de sodium[2]. Il s'agit d'un solide incolore sensible à l'oxygène utilisé au laboratoire comme réactif dans les études sur les composés organiques et organométalliques. En solution dans le dioxane, il est connu comme réactif de Collman[3].
| Tétracarbonylferrate de disodium | |
| |
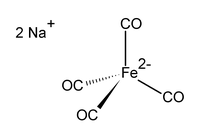
| Structure du tétracarbonylferrate de disodium. | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.035.395 |
| No CE | 238-951-0 |
| PubChem | 73357794 |
| SMILES | |
| InChI | |
| Apparence | solide incolore |
| Propriétés chimiques | |
| Formule | C4FeNa2O4 |
| Masse molaire[1] | 213,865 ± 0,006 g/mol C 22,46 %, Fe 26,11 %, Na 21,5 %, O 29,92 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le dianion [Fe(CO)4]2− est isoélectronique du tétracarbonyle de nickel Ni(CO)4[4],[5]. Le centre ferreux est tétraédrique, avec des interactions Na2+···OCFe. Il est couramment utilisé en solution dans le dioxane, qui complexe les cations de sodium. Il était initialement préparé in situ par réduction de pentacarbonyle de fer Fe(CO)5 avec un amalgame de sodium[6]. La production moderne utilise le naphtaléniure de sodium Na+ [C10H8]− ou des cétyles de benzophéniure de sodium comme réducteurs[2],[7] :
Avec un déficit de sodium, la réduction donne un diferrate octacarbonyle jaune intense[2] :
Certaines méthodes spécialisées ne commencent pas par un carbonyle de fer[8].
Réactions
modifierLe tétracarbonylferrate de sodium permet d'obtenir des aldéhydes à partir d'halogénoalcanes[9]. Il était initialement décrit pour la conversion de bromoalcanes primaires en aldéhydes correspondants par une synthèse monotope (one-pot)[6] :
Cette solution est ensuite traitée séquentiellement avec la triphénylphosphine PPh3 puis l'acide acétique CH3COOH pour donner l'aldéhyde RCHO.
Le tétracarbonylferrate de disodium peut être utilisé pour convertir les chlorures d'acyle en aldéhydes par l'intermédiaire d'un complexe acyle de fer.
Il réagit avec les haloalcanes RX pour donner des complexes alkyle de fer :
- Na2[Fe(CO)4] + RX ⟶ Na[RFe(CO)4] + NaX.
Ces alkyles de fer peuvent ensuite être convertis en acide carboxylique RCOOH et en halogénure d'acyle RCOX.
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Henry Strong, Paul J. Krusic, Joseph San Filippo Jr., Scott Keenan et Richard G. Finke, « Sodium Carbonyl Ferrates, Na2[Fe(Co)4], Na2[Fe2(Co)8], and Na2[Fe3(Co)11]. Bis[μ-Nitrido-Bis(Triphenylphosphorus)(1+)] Undeca-Carbonyltriferrate(2-), [(Ph3P)2N]2[Fe3(Co)11] », Inorganic Syntheses: Reagents for Transition Metal Complex and Organometallic Syntheses, vol. 28, (DOI 10.1002/9780470132593.ch52, lire en ligne).
- (en) Gary L. Miessler et Donald A. Tarr, Inorganic Chemistry, Pearson Education, New Jersey, États-Unis, 2004 (ISBN 978-0130354716).
- (en) Henry B. Chin et Robert Bau, « The crystal structure of disodium tetracarbonylferrate. Distortion of the tetracarbonylferrate(2-) anion in the solid state », Journal of the American Chemical Society, vol. 98, no 9, , p. 2434-2439 (DOI 10.1021/ja00425a009, lire en ligne).
- (en) Raymond G. Teller, Richard G. Finke, James P. Collman, Henry B. Chin et Robert Bau, « Dependence of the tetracarbonylferrate(2-) geometry on counterion: crystal structures of dipotassium tetracarbonylferrate and bis(sodium crypt) tetracarbonylferrate [crypt = N(CH2CH2OCH2CH2OCH2CH2)3N] », Journal of the American Chemical Society, vol. 99, no 4, , p. 1104-1111 (DOI 10.1021/ja00446a022, lire en ligne).
- (en) Manning P. Cooke Jr., « Facile conversion of alkyl bromides into aldehydes using sodium tetracarbonylferrate(-II) », Journal of the American Chemical Society, vol. 92, no 20, , p. 6080-6082 (DOI 10.1021/ja00723a056, lire en ligne).
- (en) Richard G. Finke et Thomas N. Sorrell, « Nucleophilic Acylation with Disodium Tetracarbonylferrate: Methyl 7-Oxoheptanoate and Methyl 7-Oxoöctanoate », Organic Syntheses, vol. 59, , p. 102 (DOI 10.15227/orgsyn.059.0102, lire en ligne).
- (en) Manfred Schlosser, Organometallics in Synthesis: Third Manual, John Wiley & Sons, 2013 (ISBN 978-1118484753)
- (en) Robert D. Pike, « Disodium Tetracarbonylferrate(−II) », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rd465, lire en ligne).