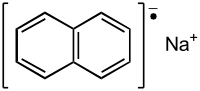
Naphtaléniure de sodium
Le naphtaléniure de sodium ou naphtalène-sodium, parfois naphtalène Na, est un composé organique radicalaire à deux noyaux aromatiques accolés, correspondant à la formule Na°C10H8 ou Na+C10H8−.
| Naphtaléniure de sodium | |
| |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.020.420 |
| No CE | 222-460-3 |
| PubChem | 11829632 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C10H8Na |
| Masse molaire[1] | 151,160 3 ± 0,008 6 g/mol C 79,46 %, H 5,33 %, Na 15,21 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Au laboratoire de chimie, cet ion radicalaire est employé comme réducteur en synthèse organique, par exemple en chimie organométallique, mais aussi en chimie minérale, en chimie macromoléculaire pour amorcer une polymérisation anionique. Ce composé n'a pu être isolé sous forme solide, il est toujours présent en solution et apparaît comme une préparation liquide de sodium métal dilué dans le solvant naphtalène : il est en pratique utilisé souvent frais après sa préparation[2].
Préparation et propriétés physiques
modifierLes naphtaléniures de métaux alcalins appartiennent à un groupe inhabituel de composés organométalliques. Ces derniers sont des produits de l'interaction d'un métal alcalin avec un hydrocarbure aromatique élevé, comprenant par exemple deux ou plusieurs cycles aromatiques reliés, comme le diphényl-1,4 butadiène ou soudés, comme l'anthracène ou ici le naphtalène.
Ils sont préparés par simple dissolution d'un métal alcalin avec du naphtalène, réactif le plus souvent dilué dans un solvant éthéré ou aprotique, tel que le tétrahydrofurane (THF), le diméthoxyéthane, ou autres éthers. Ce solvant éthéré contribue à ralentir et à mieux contrôler la réaction[3].
La solution se colore en vert foncé, cette couleur profonde étant la preuve de l'interaction des photons de la lumière avec un électron du radical[4],[5],[6]. L'anion naphtalène est bien un radical, donnant un fort signal en résonance de spin électronique avoisinant pour le facteur de Landé g = 2,0, possédant un fort potentiel rédox de l'ordre de −2,5 V vs NHE. La couleur verte profonde provient des zones efficaces du spectre d'absorption centrées vers 463 et 735 nm[2].
Le bilan de cette réaction sans dégagement d'hydrogène concerne un transfert d'électron, du sodium métal pour former l'anion-radical hydrocarbone polycyclique, paramagnétique et coloré. L'électron est stabilisé : tout se passe comme s'il pénétrait dans l'orbitale π la plus basse.
Propriétés chimiques
modifierIl est possible de procéder au dosage des hydrocarbures aromatiques d'affinité électronique élevée par potentiométrie avec le dérivé alcalin d'un hydrocarbure d'affinité électronique plus faible. Par exemple le naphtalène par le diphényl-1,4 butadiènesodium.
L'anion possesseur d'un électron libre est fortement basique, et une voie typique de dégradation implique une réaction très souvent violente et exothermique avec un solvant protique, par exemple de l'eau. Ces réactions engendrent alors un mélange de dihydronaphtalène et de naphtalène, tout en produisant l'hydroxyde alcalin correspondant, comme ici l'hydroxyde de sodium :
- 2 NaC10H8 + 2 H2O → C10H10 + C10H8 + 2 NaOH
Les solutions de naphtaléniures alcalins sont plus stables dans le THF, mais elles restent fortement réductrices. Le chlorure de cobalt peut être réduit en cobalt colloïdal. Les halogénures organiques perdent leur halogène, et ne laissent qu'un radical organique isolé, réactif potentiel, et un anion halogénure.
- C12H10− + RX → C12H10 + R• + X−
Ainsi il est possible de doser les halogènes d'origine organique. Même les dérivés fluorocarbonés, pourtant si peu ou non-réactifs, sont concernés.
Réactifs similaires plus doux
modifierPour de nombreuses synthèses, le naphtalène sodium s'avère un réducteur trop puissant, il faut préférer des réducteurs plus doux. Les composés aromatiques à nombre élevé de noyaux aromatiques accolés, effectivement plus stables et moins réactifs, sont moins réducteurs, l'électron étant plus largement partagé ou dispersé dans ces multiples cycles aromatiques. L'acénaphtène sodium a un potentiel redox plus faible vers 0,75 V.
Polymérisation anionique
modifierL'école de polymérisation anionique vivante initiée par le chimiste Michael Szwarc a employé ce type de composés organométalliques, bien stabilisé dans le tétrahydrofuranne, comme amorceur.
Références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- N. G. Connelly et W. E. Geiger, Chemical Redox Agents for Organometallic Chemistry, Chem. Rev., 1996, 96, 877-910, DOI 10.1021/cr940053x
- La réaction serait plus violente, le solvant outre son rôle de stabilisation contribue aussi à solvater l'ion du métal alcalin.
- Corey, E. J. ; Gross, Andrew W., tert-Butyl-tert-octylamine, Org. Synth., coll. « vol. 8 », , p. 93
- Cotton, F. Albert ; Wilkinson, Geoffrey (1988), Advanced Inorganic Chemistry, 5e éd., New York, Wiley-Interscience, p. 139 (ISBN 0-471-84997-9)
- Greenwood, Norman N. ; Earnshaw, Alan (1984), Chemistry of the Elements, Oxford, Pergamon Press, p. 111 (ISBN 0-08-022057-6).
Bibliographie
modifier- Jean-Pierre Mercier, Ernest Maréchal, Chimie des polymères : synthèses, réactions, dégradations, PPUR, 1993, 448 p., lire en ligne
- Sylvie Boileau, Georges Champetier et Pierre Sigwalt, Mécanisme de l'amorçage de la polymérisation des épisulfures par le naphtalène-sodium, Journal of Polymer Science Part C: Polymer Symposia, vol. 16, issue 5, 1967, p. 3021–3031, résumé