Peroxyde d'azote
Le peroxyde d'azote, ou tétraoxyde de diazote, est un composé chimique de formule N2O4. C'est un liquide incolore à jaune brun selon la concentration de dioxyde d'azote NO2 qu'il contient : N2O4 est en équilibre avec NO2, dont il constitue en fait un dimère. C'est un oxydant très puissant, corrosif et toxique. Appelé également NTO (de l'anglais Nitrogen TetrOxide) en astronautique, le peroxyde d'azote y est très employé comme propergol liquide stockable, notamment avec l'hydrazine et ses dérivés avec lesquels il forme un couple hypergolique.
| Peroxyde d'azote | |
 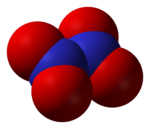 Structure du peroxyde d'azote. |
|
| Identification | |
|---|---|
| Nom UICPA | Tétraoxyde d'azote |
| No CAS | |
| No ECHA | 100.031.012 |
| No CE | 234-126-4 |
| No RTECS | QW9800000 |
| PubChem | 25352 |
| ChEBI | 29803 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore |
| Propriétés chimiques | |
| Formule | N2O4 [Isomères] |
| Masse molaire[1] | 92,011 ± 0,001 6 g/mol N 30,45 %, O 69,55 %, |
| Propriétés physiques | |
| T° fusion | −9,3 °C[2] |
| T° ébullition | 21,15 °C[2] |
| Solubilité | réagit avec l'eau |
| Masse volumique | 1,45 g cm−3 à 20 °C[2] |
| Point critique | 431 K ; 10,1 MPa ; 167 cm3 mol−1[2] |
| Thermochimie | |
| ΔvapH° | 38,12 kJ mol−1 (1 atm, 21,15 °C)[3] |
| Précautions | |
| SGH[4],[5] | |
| H270, H280, H314, H330, P220, P260, P280, P284, P310 et P305+P351+P338 |
|
| SIMDUT[6] | |
Produit non classé |
|
| Transport | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Propriétés et structure
modifierLa structure de cette molécule a été très discutée jusqu'à la fin des années 1940, où on a commencé à la comprendre[8], tout comme celle du trioxyde d'azote[9]. La molécule N2O4 est plane, avec une liaison N-N de 178 pm et des liaisons N-O de 119 pm. Contrairement à la molécule NO2, le dimère N2O4 est diamagnétique[10],[11].
Dans les années 1940 également on a montré que sous forme liquide, à la différence de l'ammoniac NH3 ou du dioxyde de soufre SO2, ce milieu n'était pas propice aux réactions inorganiques qui étaient initialement supposées possible par l'ionisation du milieu. On n'a pas trouvé à l'époque de sels minéraux solubles dans ce liquide, et compte tenu de la solubilité élevée de nombreux composés organiques, les chimistes ont alors conclu que ce liquide avait un caractère non ionisant et un comportement évoquant celui de solvants organiques tels que le benzène C6H6[12].
Sous les conditions normales de température et de pression, et en vertu de l'équilibre entre peroxyde d'azote N2O4 et dioxyde d'azote NO2, les deux espèces sont toujours présentes simultanément, l'augmentation de température déplaçant l'équilibre de cette réaction endothermique vers le dioxyde par dissociation du dimère :
Préparation
modifierLe peroxyde d'azote est produit par oxydation catalysée de l'ammoniac NH3 dans de la vapeur d'eau H2O pour limiter la température, ce qui permet d'oxyder le monoxyde d'azote N≡O en dioxyde d'azote NO2 tandis que l'eau est évacuée sous forme d'acide nitrique HNO3 ; le gaz résiduel est composé essentiellement de peroxyde d'azote, qu'il suffit alors de refroidir.
Utilisation astronautique
modifierLe peroxyde d'azote est l'un des principaux ergols utilisés aujourd'hui en propulsion spatiale. Il a remplacé l'acide nitrique d'abord utilisé comme comburant des propergols de moteurs-fusées, avec des carburants tels que le RP-1, l'UDMH ou la MMH. Les moteurs étaient protégés de l'acidité du comburant par un ajout de 0,6 % de fluorure d'hydrogène HF, plutôt cher, très toxique et de manipulation dangereuse. L'acide nitrique a été remplacé par d'autres comburants, notamment le peroxyde d'azote. Les lanceurs spatiaux et les missiles balistiques ont commencé à l'utiliser vers la fin des années 1950, lorsque les États-Unis et l'URSS l'ont choisi comme comburant formant avec l'hydrazine et ses dérivés — hydrate d'hydrazine, MMH, UDMH, Aérozine 50 et UH 25 principalement — des propergols liquides stockables hypergoliques.
Appelé NTO (pour Nitrogen Tetroxide) dans le cadre de la propulsion spatiale, le peroxyde d'azote est le comburant le plus fréquemment utilisé dans les moteurs hypergoliques. À ce titre il est mis en œuvre sur un grand nombre d'étages inférieurs conçus dans les années 1960 comme le lanceur russe Proton, l'étage Fregat des lanceurs russes Soyouz et Zenit, les fusées chinoises Longue Marche. Il a été remplacé sur ces étages par l'oxygène liquide sur les lanceurs conçus par la suite. Il reste très fréquemment utilisé sur les étages supérieurs qui conservent malgré leur toxicité des ergols hypergoliques car ils sont faciles à stocker dans les réservoirs des lanceurs et permettent de multiples allumages comme les moteurs de manœuvre orbitale (OMS) de la navette spatiale de la NASA, étage à propergol stockable (EPS) d'Ariane 5, ou encore le lanceur indien GSLV, les moteurs permettant l'insertion en orbite des sondes spatiales, etc.
Lorsqu'il est utilisé comme ergol oxydant (comburant), le peroxyde d'azote est généralement mélangé à un faible pourcentage de monoxyde d'azote N≡O pour en limiter les effets corrosifs sur les alliages de titane intervenant dans le système de propulsion des engins spatiaux : c'est ce qu'on appelle le MON (pour Mixed Oxides of Nitrogen) ; l'OMS de la navette spatiale utilise par exemple du MON-3, à 3 % de N≡O (fraction pondérale).
Synthèse
modifierLors de la combustion nitrate de cuivre + nitrate de plomb(II), du dioxyde d'azote et du peroxyde d'azote apparaissent.
Toxicité, écotoxicité
modifierLa toxicité du peroxyde d'azote inhalée est avérée et a été étudiée chez l'animal de laboratoire.
Elle découle de son caractère oxydant, qui a des effets directs sur les cellules, mais aussi d'effets de perturbation endocrinienne. Des chercheurs militaires chinois ont montré que le peroxyde d'azote affecte notamment certains facteurs produits par l'oreillette droite du cœur[13] (facteurs hormonaux qui régulent la tension). Ces mêmes chercheurs ont montré que d'autres facteurs de régulation (dits « natriurétiques »), des polypeptides (Atrial Natriuretic Polypeptide ou ANP) produits par les poumons, et présents dans le mucus pulmonaire, étaient également perturbés[14].
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Nitrogen Tetroxide » dans la base de données Hazardous Substances Data Bank (consulté le 11 juin 2010).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 90e éd., 2804 p. (ISBN 9781420090840, présentation en ligne).
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008).
- Sigma-Aldrich.
- « Tétroxyde d'azote » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- « Dinitrogen tetraoxide », sur ESIS, consulté le 11 juin 2010
- J. S. BROADLEY et J. MONTEATH ROBERTSON, Structure of Dinitrogen Tetroxide, Nature, 164, 915-915, 1949/11/26, DOI 10.1038/164915a0.
- C. K. Ingold et E. Hilda Ingold, Constitutions of Dinitrogen Tetroxide and Trioxide, Nature, 159, 743-744, 1947/05/31, DOI 10.1038/159743b0.
- Holleman, A. F. et Wiberg, E., Inorganic Chemistry, Academic Press, 2001, San Diego (ISBN 978-0-12-352651-9).
- W. ROGIE ANGUS, RICHARD W. JONES et GLYN O. PHILLIPS, Existence of Nitrosyl Ions (NO+) in Dinitrogen Tetroxide and of Nitronium Ions (NO2+) in Liquid Dinitrogen Pentoxide, Nature, 164, 433-434 (1949/11/10), DOI 10.1038/164433aZ.
- C. C. ADDISON et R. THOMPSON, Ionic Reactions in Liquid Dinitrogen Tetroxide, Nature, 162, 369-370 (1948/11/04), DOI 10.1038/162369a0.
- YE Ming Liang, XIA Ya Dong, WEN Si Zhen et GUO Xu Yi, Change in atrial natriuretic factor content in rats suffered from acute pulmonary edema induced by dinitrogen tetroxide, Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Beijing 100850 (lien vers l'article, en chinois).
- Wu Haihuan, Peng Liyi et al., Effect of dinitrogen tetroxide on atrial natriuretic polypeptide and lung surfactant in rats Ye Mingliang, Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Beijing 100850 (lien vers l'article original (en chinois)), résumé.






