Groupe pentafluorosulfanyle
En chimie, le groupe pentafluorosulfanyle est un groupe fonctionnel de formule -SF5. Le pentafluorosulfanyle est un groupe qui possède de nombreuses propriétés chimiques uniques[2] et diverses[3]. Il peut être synthétisé à travers une multitude de mécanismes réactionnels, permettant ainsi son utilisation dans des domaines variés.
| Groupe pentafluorosulfanyle | |
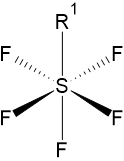
| |
| structure de la molécule de -SF5 | |
| Identification | |
|---|---|
| Nom UICPA | pentafluoro sulfanyle |
| Propriétés chimiques | |
| Formule | SF5 |
| Masse molaire[1] | 127,057 ± 0,005 g/mol F 74,76 %, S 25,24 %, |
| Cristallographie | |
| Volume | 61,3 (Å3) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Historique
modifierSF5 est un groupe fluoré dit « émergent », découvert dans les années 1960 par W. A. Sheppard[4]. Cependant, à cette époque, il n'était pas commercialisé car des réactifs dangereux étaient utilisés lors de sa synthèse. Son utilisation est devenue plus fréquente ces 20 dernières années grâce aux progrès effectués dans le secteur de la recherche scientifique. De nos jours, les molécules contenant un groupe SF5 sont utilisées dans le domaine des matériaux (cristaux liquides, écrans LCD) ainsi que dans l'industrie pharmaceutique (synthèse de médicaments). Le réactif contenant du SF5 le plus utilisé de nos jours est le chloropentafluorure de soufre (SF5Cl) gazeux, préparé par H. L. Roberts[5], en 1960.
Propriétés
modifierLe groupe -SF5 est très souvent comparé au groupe trifluorométhyle (-CF3), les deux étant des groupes fluorés avec des propriétés assez similaires[6]. On compare notamment leur géométrie et électronégativité, leur stabilité thermique et chimique ainsi que leur solubilité et polarité.
Géométrie et électronégativité
modifierLe groupe SF5 possède une géométrie octaédrique[6], comme prédit par le modèle VSEPR. De plus, dans la spectroscopie RMN 19F, les quatre noyaux de fluor « équatoriaux » d'une part, et l'atome « axial » d'autre part, sont non dégénérés et apparaissent comme un système de spin AB4.
Le -SF5 possède un volume de Van der Waals plus grand que le -CF3, 61,3 VVdW (Å3) contre 42,7 VVdW (Å3).
En raison de la présence de cinq atomes de fluor, l'atome le plus électronégatif existant, le groupe SF5 présente une forte capacité d'attraction des électrons[7], avec une électronégativité de 3,65 sur l'échelle de Pauling, tandis que celle du CF3 est de 3,36.
De plus, le -SF5 est un groupe fortement polaire[2]. Les dérives N-phényl substitué par un imide ont des moments dipolaires très grands, aux alentours de 7,53 Debye[2] ; les dérivés phénylés du -SF5 sont les dérivés qui ont les moments dipolaires les plus élevé des groupes SF5. Ceci est dû à la forte électronégativité du groupement -SF5 mais aussi à sa possibilité de délocaliser les électrons dans le cycle aromatique.
Stabilité
modifierUn effet mésomère est possible avec R-SF5, où R est un groupe aryle. En raison de l'hyperconjugaison négative, la capacité attractive du groupe -SF5 le rend plus réactif en tant qu'accepteur d'électrons[6].
Du fait de son puissant pouvoir d'accepteur d'électron, le -SF5 est un groupe fonctionnel très utilisé dans les synthèses de composés de type « donneur-accepteur »[4].
Solubilité
modifierLe groupe -SF5 est un groupe stable hydrolytiquement, plus stable de ce point de vue que CF3. C'est un groupe Lipophilielipophile et hydrophobe[2]. Ce groupe polyvalent est capable de résister à l'hydrolyse, il tolère beaucoup de réactifs chimiques et des conditions réactionnelles variées, sans être altéré[2].
Synthèse
modifierLes premières méthodes de synthèse du groupement SF5 avaient un très faible rendement, et nécessitent des conditions de réactions difficiles à mettre en place et à reproduire[2]. De plus, la synthèse dépend du composé auquel on veut ajouter le groupe, ainsi que de l'utilisation qu'on veut en faire. Le groupe -SF5 est néanmoins polyvalent synthétiquement, il peut donc être introduit à divers endroits du chemin de synthèse sans que cela interfère dans le schéma réactionnel[2].
Le schéma ci-contre montre les méthodes-clés pour la synthèse d'un arène substitué, à partir du 1,2-bis(4-nitrophényl)disulfane[2]. Il explicite notamment l'évolution de la synthèse du groupe SF5 au fil des découvertes. La synthèse de W. a. Sheppard de 1960 (voie 1) permettait d'obtenir un rendement de 9%, dans des conditions assez difficiles à mettre en œuvre. En 1997, F2 Chemicals Ltd. découvre une nouvelle voie de synthèse (voie 2) ayant un temps de réaction de 24h, qui permet d'obtenir un rendement de 41%[2]. En 2008, une nouvelle technique permet de transformer des groupes -SH, en groupe -SF5, via l'utilisation d'un intermédiaire –SF4Cl (voie 3). Cette nouvelle méthode, découverte par Umemtot et al. permet un bien meilleur rendement de synthèse, 89%. Enfin, une nouvelle voie de synthèse (voie 4) découverte par Togni et al. en 2018, puis améliorée par Shibata et al. en 2019, permet de synthétiser directement l'intermédiaire réactionnel avec rendement encore plus important.
Il existe de nombreuses voies de synthèse pour ce groupement, qui dépendent de l'utilisation que l'on veut faire du composé. En effet, il faut d'une part synthétiser le groupement - SF5 et d' autre part, synthétiser le groupement R auquel le -SF5 sera rattaché. On retrouvera les méthodes de synthèse suivantes:
- synthèse[8] des composés Ar-SF5
La synthèse des composés Ar-SF5 peut se faire suivant différents mécanismes réactionnels par exemple, via une fluoration oxydante[8]. Pour cette méthode, il faut mettre un composé aromatique – substitué ou non – en présence d'un oxydant fort. L'oxydant utilisé pourra être l'acide trichloroisocyanurique (en) (TCICA) en présence de KF, ou du Cl2 en présence de KF. Cette réaction produit un composé intermédiaire dans lequel il faut alors substituer le chlore par du fluor. Pour cela on utilise du AgF, du IF5 ou du HF. On obtient alors le composé souhaité avec un rendement inférieur ou égal à 95%[8]. On pourra ensuite utiliser ces molécules aromatiques - avec les substituants adéquats - dans différents domaines, notamment dans le domaine agricole.
- Synthèse [3] du SF5Cl, SF5Br et du S2F10
- Synthèse[5] du SF5Cl gazeux, méthode de ROBERTS
- Synthèse des composés aliphatiques R−SF4−R′ and R−SF5, par des méthodes de fluoration[3]
- Synthèse[3]des composés R–SF5 aliphatique et ses analogues via la formation de liaison S–F
- Synthèse[3] des composés aliphatiques RSF4 et SF5 via les réactifs RSF4X and SF5X
- Synthèse[3] des composés aromatiques SF5
- Synthèse d'hétérocycle avec un groupement -SF5 favorisée par l'argent[9]
Utilisations
modifierIl existe de nombreuses utilisations du groupe pentafluorosulfanyle, pour des usages complètement différents. En effet, le SF5 est un groupement présent dans des molécules utilisées dans des domaines très variés comme la médecine, pour des traitements contre la toxicomanie[3], ou encore contre des troubles cognitifs. Le SF5 est aussi utilisé pour fabriquer des écrans LCD et en agriculture.
Écrans LCD
modifierL'un des principaux usages du groupe pentafluorosulfanyle est en chimie des matériaux. Le groupe est notamment présent dans des composés utilisé pour la production d'écrans à cristaux liquides (LCD).
Le groupe SF5 possède l'avantage d'avoir un grand moment dipolaire, et d'être très stable chimiquement et photochimiquement. Ces propriétés sont idéales pour les cristaux liquides utilisés dans ces écrans, en plus de la faible polarisabilité et la très faible mobilisation d'impuretés ioniques, propriétés apportées par les atomes de fluor dus à leurs faibles énergie de surface[2].
Le groupe SF5 est préféré aux simples atomes de fluor, utilisés initialement, en tant que substituant des cristaux liquides.
Ces découvertes ont été faites par le chimiste Peer Kirsch du laboratoire Liquid Crystals Division at Merck KGaA[10], au milieu des années 1990.
Agriculture
modifierLe groupe pentafluorosulfanyle est aussi utilisé dans le domaine agricole, des herbicides, insecticides, fongicides ou encore parasiticides contenant le substituant SF5. C'est notamment le cas des diphényléthers (ou phénoxybenzènes), des herbicides très puissants utilisés pour traiter les chénopodes[3] (plantes classés comme « mauvaises herbes », qui poussent au milieu de cultures comme les betteraves sucrières et qui empêchent la croissance de ces dernières). Ces molécules sont donc utilisées en agriculture pour améliorer les rendements de production. Des études ont montré que pour une dose de 125 g/ha permettait d'éliminer 90% des chénopodes présents sur cet hectare, ce qui le place comme l'un des herbicides les plus puissants, pour traiter les chénopodes, très présentes, notamment en France.
Applications en synthèse de molécules bioactives
modifierL'addition du radical SF5 via le gaz SF5Cl ou le SF6, sur des alcynes favorise la cyclisation intra ou intermoléculaire. Cette propriété permet donc la synthèse de nombreuses molécules bioactives telle la 2-SF5-donaxine, un médicament[8] naturellement présente dans les graminées.
On peut considérer que le groupement SF5 peut favoriser la création de « briques moléculaires » puisque de nombreuses molécules peuvent être synthétisées selon le processus de cyclisation d'alcyne :
Un autre système de briques moléculaires consiste à synthétiser le vinyle-SF5 qui permet de d'additionner ensuite des molécules actives entières telles que les molécules caractérisant l'ADN comme l'adénine[8].
La présence du groupement SF5 dans le vinyle-SF5, permet d'obtenir qu'un unique stéréoisomère. En effet, grâce à ses caractéristiques physico-chimiques, le groupement SF5, oblige le nucléophile à se greffer à la molécule en position β lors de l'addition nucléophile de ce dernier.
On peut prendre l'exemple de la théophylline, un composé présent dans les feuilles de thé utilisé en la médecine, notamment pour traiter l'asthme, qui peut être additionnée sur le l'alcyne-SF5[8].
Références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Chan, Julian M. W. « Pentafluorosulfanyl Group: An Emerging Tool in Optoelectronic Materials ». Journal of Materials Chemistry C 7, nᵒ 41 (24 octobre 2019): 12822‑34. https://doi.org/10.1039/C9TC01949A.
- Savoie, Paul R., et John T. Welch. « Preparation and Utility of Organic Pentafluorosulfanyl-Containing Compounds ». Chemical Reviews 115, nᵒ 2 (28 janvier 2015): 1130‑90. https://doi.org/10.1021/cr500336u.
- Gautam, Prabhat, Craig P. Yu, Guoxian Zhang, Victoria E. Hillier, et Julian M. W. Chan, « Pulling with the Pentafluorosulfanyl Acceptor in Push–Pull Dyes », The Journal of Organic Chemistry, vol. 82, no 20, , p. 11008–11020 (DOI 10.1021/acs.joc.7b01972)
- Roberts, H. L., et N. H. Ray, « 136. Sulphur Chloride Pentafluoride: Preparation and Some Properties », Journal of the Chemical Society, no 0, , p. 665‑67 (DOI 10.1039/JR9600000665)
- Kordnezhadian, Reza, Bing-Yu Li, Armir Zogu, Joachim Demaerel, Wim M. De Borggraeve, et Ermal Ismalaj. « Chemistry of Pentafluorosulfanyl Derivatives and Related Analogs: From Synthesis to Applications ». Chemistry – A European Journal 28, nᵒ 60 (26 octobre 2022): e202201491. https://doi.org/10.1002/chem.202201491.
- Zhang, Guoxian. « Pentafluorosulfanyl (SF5): A Robust and Unique Electron- Withdrawing Group for Optoelectronic Materials », s. d.
- Sf, Le. « Le SF5 : un groupe fluoré à grand potentiel », s. d.
- Gilbert, Audrey, Xavier Bertrand, et Jean-François Paquin. « Silver-Promoted Synthesis of 5-[(Pentafluorosulfanyl)methyl]-2-oxazolines ». Organic Letters 20, nᵒ 22 (16 novembre 2018): 7257‑60. https://doi.org/10.1021/acs.orglett.8b03170.
- « Liquid crystal display technologies ». Consulté le 11 mars 2024. https://www.merckgroup.com/en/expertise/displays/solutions/liquid-crystals/lcd-technologies.html.