Gène
Un gène, du grec ancien γένος / génos (« génération, naissance, origine »)[1],[2], est, en biologie, une séquence discrète et héritable de nucléotides dont l'expression affecte les caractères d'un organisme. L'ensemble des gènes et du matériel non codant d'un organisme constitue son génome.
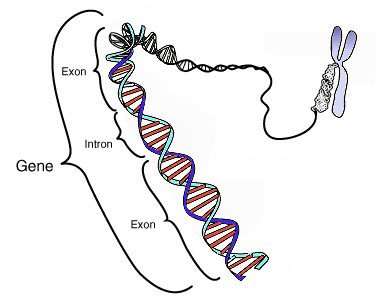
Un gène possède donc une position donnée dans le génome d'une espèce, on parle de locus génique. La séquence est généralement formée par des désoxyribonucléotides, et est donc une séquence d'ADN (par des ribonucléotides formant de l'ARN dans le cas de certains virus), au sein d'un chromosome. Elle s'exprime via la transcription, c'est-à-dire la copie de la séquence d'ADN en une molécule d'ARN. L'ARN peut ensuite subir la traduction, produisant une protéine (cas des gènes dits « codants », qui produisent des ARN messagers), ou bien être directement actif (cas des gènes dits « non codants »). Dans les deux cas, l'ARN subit après sa transcription différentes étapes de maturation, avec en particulier l'épissage, qui consiste en l'excision de parties du transcrit que l'on appelle introns. L'ARN mature est donc composé des parties restantes, à savoir des exons. Selon que le gène est codant ou non, on pourra distinguer au sein des exons les parties codantes, appelées CDS, et les parties en amont et en aval des CDS, appelées respectivement 5'- et 3'-UTR. L'expression des gènes est un processus biologique régulé de différentes manières à chacune de ses deux grandes étapes (transcription et traduction), par des séquences dites « régulatrices » (enhancers, promoters, ou autres gènes, par exemple les gènes à micro-ARN).
Au cours de la vie de l'individu (une plante, un animal, une bactérie), des gènes peuvent acquérir des mutations dans leur séquence nucléotidiques ou dans leurs régions régulatrices, comme des SNP (modification d'un nucléotide) ou des INDEL (ajout ou retrait de nucléotides). Si ces mutations se transmettent, elle entraineront la présence au sein de la population de différents allèles du gène ou de la région régulatrice, et participeront à la diversité génétique de la population. L'ensemble des allèles des gènes et des régions régulatrices d'un individu constitue son génotype. Au cours du temps, ces allèles subissent la pression de la sélection naturelle et leur fréquence peut varier sous l'effet de la dérive génétique.
La transmission des allèles des gènes des individus parents à leur descendance est à l'origine de l'héritabilité des caractères phénotypiques (par exemple la taille ou la couleur des yeux). L'ensemble des caractères phénotypiques d'un individus forment son phénotype. Dans le détails, le phénotype d'un individu est influencé par son génotype, l'environnement dans lequel il évolue ou a évolué, et les interactions entre son génotype et l'environnement. Si certains caractères sont influencés par quelques gènes (caractères oligogéniques), voire plus rarement par un seul (caractères monogéniques), la plupart des caractères phénotypiques sont sous l'influence d'un grand nombre de gènes (on parle de caractères polygéniques). Un modèle dans lequel tous les gènes influeraient dans une certaine mesure les caractères a été proposé (modèle omnigénique)[3].
Historique
modifierThéories pré-mendéliennes de l'hérédité
modifierDe nombreuses théories visant à expliquer l'hérédité des caractères (y compris des caractères acquis) ont été proposées depuis l'Antiquité jusqu'au XIXe siècle, notamment par Anaxagore, Hippocrate ou Aristote.
La théorie de la préformation, dont Aristote est un précurseur[4], a connu un certain succès à partir du XVIIe siècle et jusqu'au XIXe siècle. Cette théorie proposait que l'individu existait avant sa naissance, sous une forme complète mais trop petite pour être observée, au sein du spermatozoïde ou de l'ovule[4]. Darwin de son côté, proposait dans sa théorie de la Pangenèse, héritière d'Hippocrate et en compétition avec la théorie de la préformation, que les cellules germinales consistent en une accumulation de « gemmules », sortes d'entités sécrétées par les cellules du corps, et qui héritaient donc de leurs caractères. La rencontre des deux cellules germinales lors de la fécondation assurait la transmission des caractères à travers leur mélange[5].
Mendel et la mise en évidence des « facteurs héréditaires »
modifierEntre 1856 et 1863, à Brno dans l'empire d'Autriche, Gregor Mendel (1822—1884) réalise plusieurs milliers de croisements de plants de pois au cours desquels il observe la façon dont certains caractères ségrègent[6]. De ses travaux, il tire 5 observations :
- Les caractères se présentent sous une forme bien définie, « discrète » : fleur blanche ou violette, plant de grande taille ou de petite taille ;
- Un individus hérite de deux facteurs pour chaque caractère, un par parent (on parlerait aujourd'hui d'allèles de gènes) ;
- Un des deux allèles est dominant, et le phénotype est le reflet de cet allèle dominant (ce qui explique que dans le point 1, il n'y a pas de fleur violet pâle et de plan de taille moyenne) ;
- Les deux facteurs se séparent lors de la formation des gamètes ;
- Les paires de facteurs (couleur et taille par exemple) se séparent de façon indépendantes, elles ne sont donc pas liées (toutes les combinaisons existent donc).
Ces 5 observations sont réunies pour former les 3 lois de Mendel :
- Loi d'uniformité des hybrides de première génération : si des parents qui diffèrent pour un caractère donné et qui sont homozygotes (c'est-à-dire qu'ils ont 2 allèles identiques) pour le facteur responsable de ce caractère sont croisés, tous les descendants (les F1) seront identiques pour ce caractère. Cela vient du fait que chaque individu F1 a reçu du même parent le facteur dominant d'une part, et le facteur récessif d'autre part ;
- Loi de disjonction des allèles : chaque gamète des individus F1 de la 1re loi reçoit un, et un seul, des deux facteurs hérités de leurs parents. Un individu F1 possède donc deux types de gamètes : un qui contient le facteur dominant, l'autre qui contient le facteur récessif. Le croisement des individus F1 produit donc une population d'individus F2 dans laquelle les génotypes se répartissent selon le ratio 1 : 2 : 1 (1 homozygote dominant / dominant, 2 hétérozygotes dominant / récessif, 1 homozygote récessif / récessif). Les phénotypes en revanche suivent un ratio 3 : 1 (3 ont un phénotype correspondant à l'allèle dominant, et 1 a un phénotype correspondant à l'allèle récessif — il s'agit de l'homozygote récessif/récessif). Ces ségrégations se représentent schématiquement à l'aide d'un échiquier de Punnett ;
- Loi d'indépendance de la transmission des caractères : elle correspond à l'observation 5., c'est-à-dire que les facteurs affectant différents caractères ségrègent de façon indépendante.
Les observations et lois de Mendel ne s'appliquent qu'à assez peu de caractères. Ils se présentent en effet rarement sous une forme bien définie (plant « grand » ou « petit »), et forment plutôt en population un continuum. Par exemple, lorsqu'on mesure leur taille, on observe une distribution continue plutôt qu'une distribution discrète.
Les caractères mendéliens correspondent à des caractères monogéniques, c'est-à-dire qu'ils ne sont influencés que par un seul gène, alors que la plupart des caractères sont polygéniques. De plus, des gènes peuvent présenter un lien génétique, c'est-à-dire que leurs allèles tendent à rester ensemble lors de la formation des gamètes. Lorsque la ségrégation d'un caractère ne suit pas les lois de Mendel, on parle d'hérédité non mendélienne.
Les travaux de Mendel et ses résultats sont restés largement ignorés de son vivant, mais ont mis en évidence au début du XXe siècle par Hugo de Vries, Carl Correns et Erich von Tschermak-Seysenegg.
Découverte de l'ADN
modifierAu cours des années 1940 et 1950, des expérimentations ont montré que l'acide désoxyribonucléique (ADN) était le support physique de l'information génétique[7],[8].
La structure de l'ADN a ensuite été étudiée par cristallographie aux rayons X grâce aux travaux de Rosalind Franklin et de Maurice Wilkins. La détermination de la structure a permis à James Watson et Francis Crick de proposer le modèle de la structure en double-hélice de l'ADN.
Finalement, les travaux de Seymour Benzer ont permis de montrer que les gènes correspondent à une portion linéaire d'ADN.
Supports moléculaires de l'information génétique
modifierL'ADN
modifierL'ADN (acide désoxyribonucléique) est le support héritable de l'information génétique pour les cellules eukaryotes et prokaryotes.
La molécule d'ADN est formée de deux brins antiparallèles enroulés l'un autour de l'autre, donnant une structure en double hélice[9]. Ces brins sont composés d'une succession de bases nucléiques, ou bases azotées — adénine (A), cytosine (C), guanine (G) ou thymine (T) — liées à un pentose (le désoxyribose), lui-même lié à un groupe phosphate. Les nucléotides sont unis les uns aux autres par des liaisons covalentes entre le désoxyribose d'un nucléotide et le groupe phosphate du nucléotide suivant, formant ainsi une chaîne où alternent oses et phosphates, avec les bases nucléiques liées chacune à un ose. L'ordre dans lequel se succèdent les nucléotides le long d'un brin d'ADN constitue la séquence de ce brin : c'est cette séquence qui porte l'information génétique.
Les brins d'ADN ont un sens, qui est lié à la composition chimique des pentoses. Une extrémité d'une molécule d'ADN présente un groupe phosphate exposé, il s'agit de l'extrémité dite « 5' » [cinq prime], et l'autre extrémité présente un groupe hydroxile exposé, il s'agit de l'extrémité dite « 3' » [trois prime].
Au sein d'une cellule, on trouve une ou plusieurs molécules d'ADN de taille variable : il s'agit des chromosomes. Chez les eukaryotes, les chromosomes sont linéaires et sont séquestrés dans le noyau cellulaire, où ils sont associés avec des protéines qui en régulent la compaction, les histones. Chez les prokaryotes, on trouve en général un seul chromosome circulaire (appelé nucléoïde[10]), sans histone, et libre dans le cytoplasme, les prokaryotes n'ayant pas de noyau cellulaire. Chaque chromosome porte un allèle de chaque gène qu'il contient. Dans les espèces diploïdes, dont les individus disposent chacun d'une paire de chaque chromosome (c'est par exemple le cas des mammifères), chaque individu dispose de deux allèles pour chaque gène.
Le long d'un chromosome, on trouve donc des loci géniques (les gènes), séparés entre eux par des régions dites « intergéniques » parfois très longues. Si ces régions ont longtemps été considérées comme inutiles, la communauté scientifique s'accorde maintenant à dire qu'elles ont pour la plupart un rôle[11], et notamment qu'elles contiennent des loci impliqués dans la régulation de l'expression des gènes[12].
La séquence de nucléotides de l'ADN qui forme le gène n'est pas directement fonctionnelle. Elle le devient à la suite de sa transcription par des ARN polymérases, qui produisent de l'ARN.
L'ARN
modifierLa molécule d'ARN (acide ribonucléique) est pour sa part une succession de bases nucléiques — les mêmes que l'ADN sauf la thymine (T), qui est remplacée par de l'uracile (U) — liée à un pentose (le ribose, qui donne une partie de son nom à la molécule), lui-même lié à un groupe phosphate. Contrairement à l'ADN, la molécule d'ARN se présente généralement en un seul brin (monocaténaire). Chez les eukaryotes et les prokaryotes, l'ARN n'est pas un support de l'information génétique, mais est soit une molécule directement fonctionnelle (micro-ARN ou ARN longs non codants par exemple) soit une molécule intermédiaire permettant la synthèse de protéines.
En revanche, chez les virus à ARN, la molécule constitue le génome viral, et peut se présenter sous une forme bicaténaire.
Expression des gènes
modifierEn génétique, « expression » est un terme polysémique pouvant se rapporter (i) aux processus permettant le passage de l’information contenue dans la séquence d’ADN en un produit fonctionnel ; (ii) à la résultante, pour un locus donné, de la quantité d'ARN produits depuis de ce locus moins la quantité d'ARN issus de ce locus et dégradés ; ou (iii) à l'activité de synthèse d'ARN depuis ce locus.
Quel que soit le type de gènes, leur expression implique une première étape de transcription, c'est-à-dire la copie de l'information génétique contenue dans l'ADN en ARN. Ensuite, dans le cas des ARN messagers, suit une étape appelée traduction, réalisée par les ribosomes, qui permet le passage d'une information sous forme de nucléotides en une séquence d'acides-aminés formant une protéine. De nombreux types d'ARN (ARNt, ARNr, micro-ARN) ne subissent pas la traduction.
Transcription
modifierLa transcription consiste en la copie d'un locus donné d'ADN en ARN par une enzyme appelée ARN polymérase.
Procaryotes
modifierChez les procaryotes, elle a lieu dans le cytoplasme bactérien dans lequel est localisé l'ADN (chromosome ou plasmide), les procaryotes n'ayant pas, par définition, de noyau cellulaire. Elle se déroule en 3 étapes : l'initiation, l'élongation et la terminaison.
Eucaryotes
modifierChez les eucaryotes, elle se déroule dans le noyau cellulaire. La chromatine doit au préalable avoir été décompactée (euchromatine) pour permettre à la machinerie protéique d'accéder à l'ADN. De plus, l'ARN produit devra subir plusieurs étapes de maturation post-transcriptionnelle avant sa traduction en protéine. En particulier, des segments de cet ARN, appelés exons, sont raboutés les uns aux autres dans une étape appelée épissage ; lorsque d'autres segments, situés entre deux exons et appelés introns sont éliminés par excision.
Certains types d'ARN, dont les ARN dits « messagers » (ARNm) sont également modifiés à leur extrémité 5', par l'ajout d'une une coiffe méthylguanosine. Elle empêche notamment l'action d'exoribonucléases sur l'ARN, et facilite son export vers le cytoplasme. L'ARN est ensuite modifié à son extrémité 3', où une queue poly-A (adénine) y est ajoutée, avec des rôles similaires. L'ARN est alors mature.
Traduction
modifierLes ARN messager sont le support d'une information génétique permettant la synthèse d'une protéine. L'information génétique s'exprime par triplets de nucléotides (appelés codons), à chaque codon correspond un acide aminé. Certains codons appelés « codons STOP » n'ont pas de correspondance en acide aminé et définissent l'arrêt de la traduction de l'ARN en polypeptide. Une protéine n'est néanmoins pas simplement un enchaînement d'acides aminés et sa composition finale dépend d'autres facteurs environnementaux, c'est pourquoi à un gène ne correspond pas nécessairement une seule protéine. De plus, le processus d'épissage des introns permet également de supprimer de façon conditionnelle certains exons de l'ARN, permettant ainsi à partir d'un unique gène de produire plusieurs protéines différentes. On parle alors d'épissage alternatif. Ce phénomène, initialement décrit pour un nombre restreint de gènes, semble concerner un nombre croissant de gènes. Aujourd'hui, on estime que l'épissage alternatif permet de produire en moyenne trois ARN différents par gène, ce qui permet chez l'humain de produire, à partir de ses 20 000 à 25 000 gènes, 100 000 protéines différentes.
La plupart des cellules d'un organisme possèdent la totalité des gènes. L'ensemble des gènes exprimés dans une cellule en particulier, et donc des protéines qui seront présentes dans cette cellule, dépend de chemins de régulation complexes mis en place au cours du développement de l'individu. Certains caractères simples sont déterminés par un seul gène (comme le groupe sanguin chez l'homme ou comme la couleur des yeux chez la drosophile). Cependant, dans la plupart des cas, un caractère observable dépend de plusieurs voire de nombreux gènes, et éventuellement de l'interaction avec l'environnement (forme du visage, poids du corps).
Si les gènes sont les principaux responsables des variations entre individus, ils ne sont pas le seul support d'information dans un organisme. Ainsi, on considère que, dans le cas d'un grand nombre d'organismes, une bonne partie de l'ADN n'est pas codante (seulement 3 % est codante chez l'humain), le reste (l'ADN non codant) ayant des fonctions encore mal connues. Cet ADN non codant, aussi appelé ADN inter-génique, est de plus en plus étudié, et semble être impliqué dans la structure de la chromatine. Plus particulièrement, les dernières recherches ont montré un rôle crucial de ces régions dans la régulation de l'expression des gènes par modification de l'état de la chromatine sur de grandes régions chromosomiques.
Structure des gènes
modifierLa structure d'un gène codant pour une protéine est constituée de nombreux éléments dont la séquence codante pour la protéine proprement dite ne représente souvent qu'une petite partie. Ces éléments comprennent les introns et les régions non traduites de l'ARNm mature. Les gènes non codants peuvent également contenir des introns qui sont supprimés au cours du traitement pour produire l'ARN fonctionnel mature.
Tous les gènes sont associés à des séquence régulatrice qui sont nécessaires à leur expression. Tout d'abord, les gènes ont besoin d'une séquence promotrice. Le promoteur est reconnu et lié par des facteurs de transcription qui recrutent et aident l'ARN polymérase à se lier à la région pour initier la transcription[13]. La reconnaissance se fait généralement sous la forme d'une séquence consensus comme la boîte TATA. Un gène peut avoir plus d'un promoteur, ce qui donne des ARN messagers (ARNm) qui diffèrent par la longueur de leur extrémité 5' [14] . Les gènes fortement transcrits ont des séquences promotrices "fortes" qui forment des associations solides avec les facteurs de transcription, initiant ainsi la transcription à un rythme élevé. D'autres gènes ont des promoteurs "faibles" qui forment des associations faibles avec les facteurs de transcription et initient la transcription moins fréquemment. Les régions promotrices des eucaryotes sont beaucoup plus complexes et difficiles à identifier que les promoteurs des procaryotes[13].
En outre, les gènes peuvent avoir des régions régulatrices de plusieurs kilobases en amont ou en aval du gène qui modifient l'expression. Ces régions agissent en se liant à des facteurs de transcription qui provoquent ensuite une boucle de l'ADN de sorte que la séquence régulatrice (et le facteur de transcription lié) se rapproche du site de liaison de l'ARN polymérase [14]. Par exemple, les exhausteurs augmentent la transcription en se liant à une protéine activatrice qui aide ensuite à recruter l'ARN polymérase au promoteur ; à l'inverse, les silencieux se lient à des protéines répressives et rendent l'ADN moins disponible pour l'ARN polymérase[15].
L'ARN messager mature produit à partir de gènes codants pour des protéines contient des régions non traduites aux deux extrémités, qui contiennent des sites de liaison pour les ribosomes, les protéines de liaison à l'ARN, les miARN, ainsi que des terminateurs et des codons de départ et de d’arrêt (codon 'stop') [16]. En outre, la plupart des cadres de lecture ouverts eucaryotes contiennent des introns non traduits, qui sont éliminés, et des exons, qui sont reliés entre eux dans un processus connu sous le nom d'épissage de l'ARN. Enfin, les extrémités des transcrits sont définies par des sites de clivage et de polyadénylation (CPA), où le pré-ARNm nouvellement produit est clivé et une chaîne de ~200 adénosines monophosphates est ajoutée à l'extrémité 3'. La queue poly(A) protège l'ARNm mature de la dégradation et a d'autres fonctions, affectant la traduction, la localisation et le transport de la transcription à partir du noyau. L'épissage, suivi du CPA, génère l'ARNm mature final, qui code pour la protéine [17]. Bien que les mécanismes généraux définissant les localisations des gènes humains soient connus, l'identification des facteurs exacts régulant ces processus cellulaires est un domaine de recherche active.
De nombreux gènes procaryotes sont organisés en opérons, avec plusieurs séquences codantes pour des protéines qui sont transcrites comme une unité[18],[14]. Les gènes d'un opéron sont transcrits sous la forme d'un ARN messager continu, appelé ARNm polycistronique. Dans ce contexte, le terme cistron est équivalent à gène. La transcription de l'ARNm d'un opéron est souvent contrôlée par un répresseur qui peut se trouver dans un état actif ou inactif selon la présence de métabolites spécifiques[19]. Lorsqu'il est actif, le répresseur se lie à une séquence d'ADN située au début de l'opéron, appelée région opérateur, et réprime la transcription de l'opéron ; lorsque le répresseur est inactif, la transcription de l'opéron peut avoir lieu (voir par exemple l'opéron Lac). Les produits des gènes de l'opéron ont généralement des fonctions apparentées et sont impliqués dans le même réseau de régulation.
Régulation des gènes
modifierSegments cis-régulateurs chez les eucaryotes
modifierL'ADN humain se compose de 1,5 % de séquences codant les gènes qui sont activés par des segments cis-régulateurs activateurs situés à proximité dans les 98,5 % d'ADN non codant[20]. 99 % de nos gènes sont communs avec la souris. 5 000 de nos segments cis-régulateurs sont communs avec les requins. Les génomes de 20 espèces très différentes (mouches, poissons, oiseaux, rongeurs, singes, humains) se composent en moyenne de 20 000 gènes et montrent de très grandes similitudes entre leurs gènes et entre leurs segments régulateurs. Les variations de caractères génétiques sont plus souvent dues aux mutations d'activateurs qu'aux mutations de gènes.
Dans les tissus, des protéines reconnaissent et se lient aux segments cis-régulateurs et activent les gènes[20]. Le complexe protéique qui se forme alors active l'enzyme polymérase et enclenche la transcription du gène. La plus longue distance observée est de 4 500 paires de bases entre un gène et un segment régulateur[20]. Certains gènes sont activés indépendamment dans plusieurs tissus par des segments différents. Ces gènes sont encore plus stables car soumis à des contraintes organiques plus nombreuses[20].
Pour étudier les segments cis-régulateurs, on en génère un et on le lie à un gène dont l'effet est facile à observer. Puis on l'introduit dans un embryon unicellulaire[20]. Si on observe l'effet, c'est que le segment est régulateur, et l'observation indique sa position dans l'organisme en développement.
Chez les procaryotes
modifierLe génome procaryote est activé par défaut. Il s’agit ici d’empêcher la transcription, et non de l'activer, contrairement aux eucaryotes où les gènes ont tendance à être réprimés par défaut. Il existe cependant certains principes d’activation chez les bactéries (opéron lactose…).
La définition du gène doit prendre en compte le fait que l'on retrouve chez la bactéries des opérons, c'est-à-dire des gènes dits « polycistroniques ». Cette appellation est fautive au sens où le mot cistron est un synonyme strict du mot gène.
Un opéron est un gène procaryote qui code plusieurs protéines qui sont souvent impliquées dans un même processus biologique. Un seul ARNm est produit qui servira ensuite de matrice à la production des différentes protéines.
Il n'existe aucune documentation attestant de l'existence d'opérons chez les eucaryotes.
L'ARNm procaryote ne subit pas d'épissage, il n'y a pas d'épissage comme celui décrit chez les eucaryotes, et pas de notion d'exon ou d'intron par voie de conséquence.
Gène égoïste
modifierDans son ouvrage Le Gène égoïste, Richard Dawkins expose en 1976 une théorie donnant au gène le rôle d'unité sur laquelle agit la sélection naturelle. Les individus n'auraient d'autre intérêt que d'assurer la transmission des gènes qu'ils portent (une idée qui donne son titre au livre Les Avatars du gène de Pierre-Henri Gouyon, Jean-Pierre Henry et Jacques Arnould, 1997). Il peut exister des conflits entre le niveau du gène et celui de l'individu : les gènes portés par la fraction du génome transmise par la voie femelle ont intérêt à produire plus de descendants femelles et à manipuler l'individu qui les porte dans ce sens, pour lequel il est plus favorable dans la plupart des cas de produire autant de mâles que de femelles. La notion de gène égoïste se rapproche en fait du concept de sélection de parentèle en cela que le gène qui dicte un acte altruiste au bénéfice d'un autre individu apparenté favorise en fait sa propre transmission.
Dans cette approche, les gènes ont la particularité de ne pas être sujets au vieillissement. Un gène n'est pas plus à risque de disparaître après un million d'années que lors de son apparition. L'espérance de vie d'un gène est de l'ordre de milliers voire de millions d'années[21].
Types de gènes et vocabulaire technique
modifierLe terme de gène est tellement large qu'il est parfois difficile d'en donner une définition. De nombreux dérivés, au sens beaucoup plus précis, et parfois technique, sont utilisés couramment dans le milieu scientifique.
- Gène à action zygotique : gène qui ne s'exprime que chez le zygote et qui n'est pas une contribution maternelle à l'ovocyte.
- Gène à effet maternel (Maternal-Effect Gene) : gène à expression maternelle; gène maternel dont les produits d'expression dans le cytoplasme de l'ovule favorisent le développement du futur embryon ; ce gène contribue au phénotype du descendant en fonction de son expression chez la mère.
- Gènes activant la recombinaison (RAG ; Recombination Activating Genes) : ensemble de gènes codant des protéines qui jouent un rôle fondamental dans le réarrangement d'autres gènes. Par exemple, les gènes RAG-1 et RAG-2 codent des protéines qui activent le réarrangement des gènes de récepteurs antigéniques.
- Gènes additifs : gènes dont l'effet net est la somme des effets de leurs allèles individuels, ils ne présentent ni dominance ni épistasie.
- Gène antisens : gène qui produit un ARN complémentaire au transcrit d'un gène normal, généralement construit en intervertissant la région codante par rapport au promoteur.
- Gène architecte : gène qui contrôle le développement embryonnaire.
- Gène candidat : l'approche gène candidat consiste à supposer l'implication d'un gène dans un quelconque effet a priori, et l'étude vise à confirmer cette implication a posteriori.
- Gène candidat positionnel : gène connu pour être localisé à proximité d'un marqueur d'ADN lié à un caractère contrôlé par un seul locus ou à un QTL (locus à effets quantitatifs), et dont la fonction déduite suggère qu'il peut être la source de la variation génétique du caractère en question.
- Gène candidat positionnel par cartographie comparée : se réfère à un moyen indirect d'attribuer une fonction à un QTL. Lorsqu'un QTL est lié à un marqueur pour une espèce, et que ce même marqueur est lié à un gène connu dans une espèce modèle, des prédictions peuvent être faites concernant la nature du QTL.
- Gène candidat positionnel : gène connu pour être localisé à proximité d'un marqueur d'ADN lié à un caractère contrôlé par un seul locus ou à un QTL (locus à effets quantitatifs), et dont la fonction déduite suggère qu'il peut être la source de la variation génétique du caractère en question.
- Gène chimère marqueur de sélection : gène fabriqué à partir de morceaux de deux ou de plusieurs gènes différents et qui permet à la cellule hôte de survivre dans des conditions qui, autrement, entraîneraient sa mort.
- Gène chimère ou gène de fusion : gène modifié génétiquement, obtenu lorsqu'une séquence codante est fusionnée avec un promoteur et/ou d'autres séquences dérivées d'un gène différent. La plupart des gènes utilisés dans la transformation sont chimériques.
- Gènes complémentaires : deux ou plusieurs gènes interdépendants, pour lesquels (dans le cas de complémentarité dominante) l'allèle dominant de l'un d'eux peut produire un effet sur le phénotype d'un organisme seulement si l'allèle dominant du second gène est présent; dans le cas de complémentarité récessive, seuls les individus doubles homozygotes récessifs peuvent exprimer l'effet.
- Gène constitutif : gène qui est toujours exprimé (sans mécanisme de régulation) ; c'est-à-dire un gène d'entretien (gène de ménage ; gène domestique ou housekeeping gene) ; gène s'exprimant de la même manière dans toutes les cellules d'un organisme ; le produit d'expression de ce gène est indispensable à la vie de la cellule (à son métabolisme de base). Très souvent, ces gènes ne possèdent pas de boîte TATA.
- Gènes cytoplasmiques : gènes localisés sur l'ADN en dehors du noyau, c'est-à-dire dans les plastes et les mitochondries.
- Gène d'ancrage : gène qui a été localisé sur la carte physique et la carte de liaison d'un chromosome, et permettant ainsi leur alignement mutuel.
- Gène d'avirulence ou gène avr : plusieurs plantes contiennent des gènes R qui confèrent une résistance à hérédité simple à une race spécifique de pathogène. Les plantes sont capables de reconnaître la présence du pathogène par une interaction entre leur gène R et le gène d'avirulence correspondant du pathogène. La reconnaissance réussie déclenche l'activation en cascade de nouveaux gènes, menant souvent à une réponse hypersensible.
- Gène de novo : gène nouveau qui ne provient pas de gènes préexistants, mais de l'ADN non codant.
- Gènes de parité segmentaire : gène qui influence la formation des segments du corps chez la Drosophile.
- Gène de polarité segmentaire : gène qui fonctionne pour définir les composants antérieurs et postérieurs des segments du corps (gène Hedgehog identifié chez la Drosophile).
- Gène délétère : gène dont l'altération (à la suite d'une mutation, par exemple) entraîne un problème au niveau de son expression, ce qui conduit à l'apparition d'un caractère phénotypique anormal.
- Gène des organites : gènes localisés dans les organites en dehors du noyau.
- Gène d'histocompatibilité : ensemble de gènes qui codent les antigènes du Complexe Majeur d'Histocompatibilité (CMH).
- Gène d'intérêt (transgène) : gène codant une protéine d'intérêt ; ce gène est introduit expérimentalement dans un organisme (qui devient un organisme génétiquement modifié ou OGM ou organisme transgénique) afin que ce dernier produise la protéine en question.
- Gène disrupteur : employé pour renforcer la stérilité des graines obtenues à partir des cultures génétiquement modifiées.
- Gène domestique, gène de ménage : gène qui assure les fonctions indispensables à la vie de tous les types de cellules.
- Gènes empilés : gènes qui se réfèrent à l'insertion de deux ou de plusieurs gènes dans le génome d'un organisme. Un exemple serait une plante portant un transgène Bt donnant la résistance à un insecte et un transgène bar donnant la résistance à un herbicide spécifique.
- Gène extranucléaire : gène qui se trouve ailleurs que dans le noyau (ex.: dans les mitochondries, plastes).
- Gène fragmenté : chez les eucaryotes, l'ADN codant de plusieurs gènes structuraux est composé d'exons et d'introns. Ce modèle d'interruption généralement trouvé dans la séquence codante est désigné sous le nom de « gène fragmenté ».
- Gène gus : gène dE. coli qui code la bétaglucuronidase (GUS). Puisque cette activité est absente chez les plantes, ce gène est généralement utilisé comme gène rapporteur pour détecter l'occurrence des évènements de transformation.
- Gène hémizygote : gène qui n'est présent qu'en une seule copie dans un organisme diploïde (on peut citer comme exemple les gènes liés au chromosome X chez les mammifères de sexe mâle).
- Gènes homéotiques : gènes agissant en harmonie pour déterminer les modèles fondamentaux de développement. Les gènes homéotiques contrôlent le développement embryonnaire.
- Gène immédiat précoce : gène viral exprimé immédiatement après l'infection.
- Gène inductible : gène qui s'exprime uniquement en présence d'un métabolite spécifique, l'inducteur.
- Gène létal : forme mutante d'un gène, fatale à l'état homozygote.
- Gène létal récessif : gène codant une protéine qui est nécessaire pour le passage de l'organisme à l'état adulte. Si les deux allèles de ce gène sont présents à l'état récessif, le fœtus a des problèmes pour se développer ; il meurt à la naissance ou peu après.
- Gène lié ou marqueur lié : gène ou marqueur lié à un autre gène ou marqueur.
- Gène majeur : gène dont l'expression a un effet majeur sur le phénotype.
- Gène marqueur : gène dont la fonction ou la position sont connues, utilisé dans la sélection assistée par marqueurs (SAM) ou dans les études génétiques.
- Gène marqueur de résistance aux antibiotiques (ARMG pour antibiotic resistance marker gene) : gènes généralement d'origine bactérienne utilisés comme marqueurs de sélection en transgénèse, car leur présence permet la survie des cellules en présence d'agents antibiotiques normalement toxiques. Ces gènes étaient utilisés dans le développement et la libération de la première génération d'organismes transgéniques (particulièrement chez les plantes cultivées), mais ils ne sont plus recommandés à cause des risques potentiels associés au transfert non désiré de la résistance aux antibiotiques à d'autres organismes.
- Gène modificateur : gène qui affecte l'expression de certains autres gènes.
- Gènes modulateurs : gènes pouvant modifier le phénotype grâce aux ARN ou protéines dont ils gouvernent la synthèse. Ils peuvent stimuler, ralentir ou inhiber l'expression d'autres gènes.
- Gène mutable : gène qui a une fréquence de mutation exceptionnellement élevée.
- Gène orphelin : gène dont la séquence ne montre aucune similarité, ou homologie, avec des gènes connus.
- Gène par : classe de gènes nécessaires à la ségrégation fidèle du plasmide au cours de la division cellulaire. Initialement, les locus par étaient identifiés dans les plasmides, mais plus tard, ils ont été également trouvés dans les chromosomes bactériens.
- Gènes paralogues : gènes ayant évolué à partir de la duplication d'un même gène de départ.
- Gène polymorphe (polymorphic gene) : gène existant sous plusieurs formes (différentes formes alléliques).
- Gènes R : classe de gènes végétaux qui confèrent la résistance à une souche spécifique (ou à un ensemble de souches) d'un pathogène particulier. Leur fonction primaire est de détecter la présence du pathogène et de déclencher les voies de défense de la plante. Des gènes R ont été clonés à partir d'un certain nombre d'espèces végétales.
- Gène rapporteur : gène codant une substance facilement analysable. Utilisé comme marqueur pour confirmer l'incorporation d'un transgène dans une cellule, un organe ou un tissu, et en tant que moyen d'examiner l'efficacité de promoteurs spécifiques.
- Gène régulateur : gène dont la fonction primaire est de contrôler le taux de synthèse des produits d'un ou de plusieurs autres gènes ou voies.
- Gène répressible : gène dont l'expression peut être réduite ou anéantie par la présence d'une molécule régulatrice.
- Gènes rol : famille de gènes présents sur le plasmide Ri d'Agrobacterium rhizogenes, qui induisent la formation de racines lorsqu'ils sont transférés à une plante, à la suite d'une infection par la bactérie. Ces gènes sont utilisés comme un moyen d'induction racinaire chez différentes espèces et cultivars d'arbres fruitiers micropropagés.
- Gène sauteur ou élément transposable ou transposon : élément d'ADN qui peut se déplacer d'un endroit à un autre dans le génome.
- Gène structural : gène codant un polypeptide qui possède des fonctions enzymatiques ou structurales et qui est nécessaire pour le métabolisme normal et la croissance d'une cellule ou d'un organisme.
- Gène suppresseur de tumeur : gène qui règle la croissance cellulaire. Si un tel gène devient non fonctionnel et la cellule subit une altération, alors une croissance non contrôlée ou un cancer pourrait en résulter.
- Gènes vir : gènes sur un plasmide Ti ou Ri qui préparent le segment d'ADN-T pour le transfert dans une cellule végétale.
- Pseudogènes : gènes qui par suite de modification de sa séquence, ne peut plus être transcrit en ARN et/ou traduit en protéines. Ce sont des gènes non exprimés.
Nomenclature de localisation d'un gène (locus)
modifier- La localisation d'un gène est fondée sur un modèle standard de bandes claires et sombres obtenues après application d'une technique de coloration.
- Le gène est d'abord localisé par le numéro du chromosome pour les autosomes (chromosomes non sexuels) — 1 à 22 chez l’humain — et par une lettre pour les chromosomes sexuels.
- Une lettre suit la désignation du chromosome, p (désignant le petit bras du chromosome) ou q (désignant le grand bras du chromosome).
- La localisation est obtenue par les deux nombres suivants qui représentent la région et une bande. Plus le nombre indiquant la région est grand, plus elle est éloignée du centromère.
- Enfin il existe parfois un point suivi d'un ou deux chiffres représentant une sous-bande.
Cette nomenclature est utilisée principalement chez l’humain, mais pas uniquement. Ainsi le gène ABO (responsable des groupes sanguins ABO) est en 9q34 chez l’humain et en 3p13 chez le surmulot.
Notes et références
modifier- Informations lexicographiques et étymologiques de « Gène » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales.
- « gène », dictionnaire Larousse.
- (en) Evan A. Boyle, Yang I. Li et Jonathan K. Pritchard, « An Expanded View of Complex Traits: From Polygenic to Omnigenic », Cell, vol. 169, no 7, , p. 1177–1186 (PMID 28622505, PMCID PMC5536862, DOI 10.1016/j.cell.2017.05.038, lire en ligne, consulté le ).
- (en) Jane Maienschein, « Epigenesis and Preformationism », sur plato.stanford.edu (consulté le ).
- Charles,. Darwin et Michel Prum (trad. de l'anglais), La variation des animaux et des plantes à l'état domestique, Paris, H. Champion, , 1316 p. (ISBN 978-2-7453-2967-7 et 2-7453-2967-7, OCLC 905852568, lire en ligne).
- (en) Robin Marantz Henig, The Monk in the Garden : The lost and found genius of Gregor Mendel, the father of genetics, Houghton Mifflin, , 312 p. (ISBN 0-395-97765-7, 978-0-395-97765-1 et 0-618-12741-0, OCLC 43648512, présentation en ligne).
- O. T. Avery, C. M. Macleod et M. McCarty, « Studies on the Chemical Nature of the Substance Inducing Transformation of Pneumococcal Types : Induction of Transformation by a Desoxyribonucleic Acid Fraction Isolated From Pneumococcus Type III », The Journal of Experimental Medicine, vol. 79, no 2, , p. 137–158 (ISSN 0022-1007, PMID 19871359, PMCID 2135445, DOI 10.1084/jem.79.2.137, lire en ligne, consulté le ).
- A. D. Hershey et M. Chase, « Independent functions of viral protein and nucleic acid in growth of bacteriophage », The Journal of General Physiology, vol. 36, no 1, , p. 39–56 (ISSN 0022-1295, PMID 12981234, PMCID 2147348, DOI 10.1085/jgp.36.1.39, lire en ligne, consulté le ).
- (en) J. D. Watson et F. H. C. Crick, « Molecular Structure of Nucleic Acids: A Structure for Deoxyribose Nucleic Acid », Nature, vol. 171, no 4356, , p. 737–738 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/171737a0, lire en ligne, consulté le ).
- (en) Martin Thanbichler, Sherry C. Wang et Lucy Shapiro, « The bacterial nucleoid: A highly organized and dynamic structure », Journal of Cellular Biochemistry, vol. 96, no 3, , p. 506–521 (ISSN 0730-2312 et 1097-4644, DOI 10.1002/jcb.20519, lire en ligne, consulté le ).
- (en) Hongzhu Qu et Xiangdong Fang, « A Brief Review on the Human Encyclopedia of DNA Elements (ENCODE) Project », Genomics, Proteomics & Bioinformatics, vol. 11, no 3, , p. 135–141 (PMID 23722115, PMCID PMC4357814, DOI 10.1016/j.gpb.2013.05.001, lire en ligne, consulté le ).
- (en) The ENCODE Project Consortium, Michael P. Snyder, Thomas R. Gingeras et Jill E. Moore, « Perspectives on ENCODE », Nature, vol. 583, no 7818, , p. 693–698 (ISSN 0028-0836 et 1476-4687, PMID 32728248, PMCID PMC7410827, DOI 10.1038/s41586-020-2449-8, lire en ligne, consulté le ).
- Alexander Johnson, Julian Lewis, Martin Raff et Keith Roberts, Molecular biology of the cell, Garland Science, (ISBN 0-8153-3218-1, 978-0-8153-3218-3 et 0-8153-4072-9, OCLC 48122761, lire en ligne)
- « Table 1: The Single Nucleotide Polymorphisms in cathepsin B protein mined from literature (PMID: 16492714). », sur dx.doi.org (consulté le ).
- (en) Glenn A. Maston, Sara K. Evans et Michael R. Green, « Transcriptional Regulatory Elements in the Human Genome », Annual Review of Genomics and Human Genetics, vol. 7, no 1, , p. 29–59 (ISSN 1527-8204 et 1545-293X, DOI 10.1146/annurev.genom.7.080505.115623, lire en ligne, consulté le )
- Flavio Mignone, Carmela Gissi, Sabino Liuni et Graziano Pesole, « [No title found] », Genome Biology, vol. 3, no 3, , reviews0004.1 (PMID 11897027, PMCID PMC139023, DOI 10.1186/gb-2002-3-3-reviews0004, lire en ligne, consulté le )
- (en) Alicia A. Bicknell, Can Cenik, Hon N. Chua et Frederick P. Roth, « Introns in UTRs: Why we should stop ignoring them », BioEssays, vol. 34, no 12, , p. 1025–1034 (DOI 10.1002/bies.201200073, lire en ligne, consulté le )
- (en) Heladia Salgado, Gabriel Moreno-Hagelsieb, Temple F. Smith et Julio Collado-Vides, « Operons in Escherichia coli : Genomic analyses and predictions », Proceedings of the National Academy of Sciences, vol. 97, no 12, , p. 6652–6657 (ISSN 0027-8424 et 1091-6490, PMID 10823905, PMCID PMC18690, DOI 10.1073/pnas.110147297, lire en ligne, consulté le )
- (en) François Jacob et Jacques Monod, « Genetic regulatory mechanisms in the synthesis of proteins », Journal of Molecular Biology, vol. 3, no 3, , p. 318–356 (DOI 10.1016/S0022-2836(61)80072-7, lire en ligne, consulté le )
- "La régulation des gènes, moteur de l'évolution", Sean Carroll, Benjamin Prud'homme et Nicolas Gompel, Pour la Science, no 375, 01/2009, p. 48-59.
- (en) Richard Dawkins, Charles Simonyi Professor of the Public Understanding of Science Richard Dawkins, David Dawkins et RICHARD AUTOR DAWKINS, The Selfish Gene, Oxford University Press, , 372 p. (ISBN 978-0-19-286092-7, lire en ligne), p. 34.
Voir aussi
modifierBibliographie
modifier- Rosine Chandebois, Le gène et la forme ou la démythification de l'ADN, préface de René Thom, éditions Espaces 34.
- André Pichot, Histoire de la notion de gène, éditions Flammarion, coll. « Champs », 1999.
- Matt Ridley, Génome : autobiographie de l'espèce humaine en vingt-trois chapitres, éditions Robert Laffont.
Articles connexes
modifier- Acide désoxyribonucléique (ADN)
- Atlas of Genetics and Cytogenetics in Oncology and Haematology
- Code génétique
- Évolution (biologie)
- Famille de gènes
- Génome
Liens externes
modifier
- Ressources relatives à la santé :
- Ressource relative à la recherche :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- (en) Nombre de gènes dans le génome humain
- Que disent nos gènes ? CYCLE DE 3 CONFÉRENCES (vidéo) par Andras Paldi