Tris-acétylacétonate de fer(III)
Le tris-acétylacétonate de fer(III), ou Fe(acac)3, est un complexe de coordination de formule chimique Fe(C5H7O2)3. Il se présente sous la forme d'un solide rouge stable au contact de l'air, soluble dans les solvants organiques apolaires. On l'obtient en traitant de l'hydroxyde de fer(III) Fe(OH)3 avec de l'acétylacétone CH3COCH2COCH3[3] :
| Tris-acétylacétonate de fer(III) | |
| |
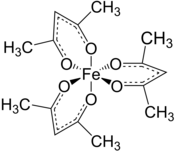
| Structure du tris(acac)Fe(III) | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.034.398 |
| No CE | 237-853-5 |
| No RTECS | NO8960000 |
| PubChem | 5483663 |
| SMILES | |
| InChI | |
| Apparence | solide rouge[1] |
| Propriétés chimiques | |
| Formule | C15H21FeO6 |
| Masse molaire[2] | 353,169 ± 0,017 g/mol C 51,01 %, H 5,99 %, Fe 15,81 %, O 27,18 %, |
| Propriétés physiques | |
| T° fusion | 180 à 183 °C[1] |
| Précautions | |
| SGH[1] | |
| H318, H331, H302+H312, P280, P310, P301+P330+P331, P302+P352, P304+P340 et P305+P351+P338 |
|
| NFPA 704[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
- Fe(OH)3 + 3 CH3COCH2COCH3 ⟶ Fe(C5H7O2)3 + 3 H2O.
Le tris-acétylacétonate de fer(III) est un complexe avec six liaisons Fe–O de longueur d'environ 200 pm. La géométrie régulière est cohérente avec un noyau Fe3+ haut spin. Dans la mesure où les électrons se répartissent équitablement dans toutes les orbitales du métal, le complexe n'est pas sujet à l'effet Jahn-Teller et adopte par conséquent une symétrie moléculaire D3, contrairement au tris-acétylacétonate de manganèse(III) adopte une configuration octaédrique plus distordue[4]. Les cinq électrons célibataires des orbitales d ont également pour effet de rentre le complexe paramagnétique, avec un moment magnétique de 5,90 μB. Il présente une chiralité axiale dont les énantiomères Δ et Λ s'interconvertissent suffisamment lentement pour être résolus au moins partiellement[5].
Il a été étudié comme précatalyseur et réactif en chimie organique, bien que l'espèce contenant du fer n'est généralement pas identifiée dans ces processus. Dans un cas, on a pu montrer qu'il favorise la conversion d'un diène en alcène[6]. Il catalyse une dimérisation de l'isoprène en un mélange de 1,5-diméthyl-1,5-cyclooctadiène et 2,5-diméthyl-1,5-cyclooctadiène[7].
Il catalyse également la polymérisation par ouverture de cycle de la 1,3-benzoxazine (en)[8], ainsi que la réaction de N-sulfonyl oxaziridines avec des alcènes pour former des produits 1,3-oxazolidine[9].
Notes et références
modifier- « Fiche du composé Iron(III) 2,4-pentanedionate », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Mihir Chaudhari, Sanjay Dehury, Siddhartha Dhar, Upasana Bora, Boyapati Choudary et Lakshmi Mannepalli pour Council of Scientific and Industrial Research CSIR, Brevet U.S. 20040127690A1 : Process for making metal acetylacetonates, déposé le 31 décembre 2002, publié le 16 octobre 2007, sur Google Patents.
- (en) Katheryn E. Lawson, « The infrared absorption spectra of metal acetylacetonates », Spectrochimica Acta, vol. 17, no 3, , p. 248-258 (DOI 10.1016/0371-1951(61)80071-4, Bibcode 1961AcSpe..17..248L, lire en ligne)
- (en) Anders Lennartson, « Optical resolution and racemisation of [Fe(acac)3] », Inorganica Chimica Acta, vol. 365, no 1, , p. 451-453 (DOI 10.1016/j.ica.2010.07.066, lire en ligne)
- (en) James M. Takacs, Lawrence G. Anderson, G. V. Bindu. Madhavan, Mark W. Creswell, Franklin L. Seely et Wayne F. Devroy, « Transition-metal-catalyzed carbon-carbon bond forming reactions: regio- and chemoselective iron(0)-catalyzed diene to olefin cross-coupling reactions », Organometallics, vol. 5, no 11, , p. 2395-2398 (DOI 10.1021/om00142a044, lire en ligne)
- (en) Misono Akira, Uchida Yasuzo, Hidai Masanobu et Ohsawa Yoshiro, « The Oligomerization of Isoprene by Cobalt or Iron Complex Catalysts », Bulletin of the Chemical Society of Japan, vol. 39, no 11, , p. 2425-2429 (DOI 10.1246/bcsj.39.2425, lire en ligne)
- (en) Atsushi Sudo, Shoji Hirayama et Takeshi Endo, « Highly efficient catalysts-acetylacetonato complexes of transition metals in the 4th period for ring-opening polymerization of 1,3-benzoxazine », Journal of Polymer Science Part A: Polymer Chemistry, vol. 48, no 2, , p. 479-484 (DOI 10.1002/pola.23810, lire en ligne)
- (en) Kevin S. Williamson et Tehshik P. Yoon, « Iron-Catalyzed Aminohydroxylation of Olefins », Journal of the American Chemical Society, vol. 132, no 13, , p. 4570-4571 (PMID 20232850, PMCID 2857537, DOI 10.1021/ja1013536, lire en ligne)




