Protéine de liaison à la vitamine D
La protéine de liaison à la vitamine D ou vitamine D-binding protein (DBP), aussi à l'origine connue comme gc-globuline, est une protéine codée chez l'humain par le gène GC situé sur le chromosome 4 humain[5],[6].
| GC | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
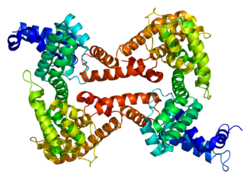 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Structure de la protéine GC. Basé sur l'identification PDB 1j78. | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifiants | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Aliases | GC, Protéine de liaison à la vitamine D, Vitamine D-binding protein, DBP, gc-globuline | ||||||||||||||||||||||||||||||||||||||||||||||||||
| IDs externes | OMIM: 139200 MGI: 95669 HomoloGene: 486 GeneCards: GC | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Structure
modifierLa protéine de liaison à la vitamine D est une alpha-globuline glycosylée d'environ 58 kDa. Ses 458 acides aminés sont codés par 1690 nucléotides sur le chromosome 4 (4q11q13). Sa structure primaire contient 28 résidus cystéine formant de multiples ponts disulfures. La protéine de liaison à la vitamine D possède trois domaines protéiques : le domaine 1 est composé de 10 hélices alpha, le domaine 2 de 9 et le domaine 3 de 4[7],[8].
Fonction
modifierLa protéine de liaison à la vitamine D appartient à la famille des albumines, tout comme l'albumine sérique humaine (ou sérumalbumine) et l'alpha-fœtoprotéine. C'est une protéine multifonctionnelle qui se trouve notamment dans le plasma, le liquide ascitique, le liquide céphalo-rachidien et à la surface de nombreux types de cellules.
La protéine de liaison à la vitamine D peut lier les différentes formes de la vitamine D, parmi lesquelles l'ergocalciférol (vitamine D2) et le cholécalciférol (vitamine D3), les formes 25-hydroxylées (par exemple le 25-hydroxycholécalciférol) et la forme active 1,25-dihydroxycholécalciférol (calcitriol). La majeure partie de la vitamine D dans le sang est liée à cette protéine. Elle transporte les métabolites de la vitamine D entre la peau, le foie et les reins, puis sur les différents tissus cibles[9].
Elle se lie également à des acides gras ou à des monomères d'actine[10].
Synthèse
modifierElle est synthétisée par les hépatocytes et sécrétée dans le sang.
Variations génétiques
modifierPlus d'une centaine de variants génétiques du gène GC sont connus, avec des affinités variables avec la vitamine S[11]. Cela explique des différences de concentration de 25-hydroxyvitamine D circulante[12]. Ils ont été proposés pour expliquer certaines différences dans la concentration en vitamine D chez les différents groupes populationnels[13] et une corrélation a été mise en évidence entre la présence de ces variants et la réponse à une supplémentation en vitamine D[14].
La délétion homozygote du gène entraîne un tableau de fragilité osseuse avec ostéopénie, un taux sanguin de vitamine D effondrée, résistante à la supplémentation[15].
Références
modifier- GRCh38: Ensembl release 89: ENSG00000145321 - Ensembl, May 2017
- GRCm38: Ensembl release 89: ENSMUSG00000035540 - Ensembl, May 2017
- « Publications PubMed pour l'Homme », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- « Publications PubMed pour la Souris », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- (en) « Possible localization of Gc-System on chromosome 4. Loss of long arm 4 material associated with father-child incompatibility within the Gc-System », Human Heredity, vol. 27, no 2, , p. 105–7 (PMID 558959, DOI 10.1159/000152857)
- (en) « Entrez Gene: GC group-specific component (vitamin D binding protein) »
- (en) « A structural basis for the unique binding features of the human vitamin D-binding protein », Nature Structural Biology, vol. 9, no 2, , p. 131–6 (PMID 11799400, DOI 10.1038/nsb754)
- (en) « GC - Vitamin D-binding protein precursor - Homo sapiens (Human) - GC gene & protein », sur www.uniprot.org (consulté le )
- (en) « From vitamin D to hormone D: fundamentals of the vitamin D endocrine system essential for good health », The American Journal of Clinical Nutrition, vol. 88, no 2, , p. 491S-499S (PMID 18689389)
- Chun RF, New perspectives on the vitamin D binding protein, Cell Biochem Funct, 2012;30:445-456
- Arnaud J, Constans J, Affinity differences for vitamin D metabolites associated with the genetic isoforms of the human serum carrier protein (DBP), Hum Genet, 1993;92:183-188
- (en) « A systematic review of the association between common single nucleotide polymorphisms and 25-hydroxyvitamin D concentrations », The Journal of Steroid Biochemistry and Molecular Biology, vol. 121, nos 1–2, , p. 471–7 (PMID 20363324, DOI 10.1016/j.jsbmb.2010.03.073)
- (en) « Vitamin D-binding protein and vitamin D status of black Americans and white Americans », The New England Journal of Medicine, vol. 369, no 21, , p. 1991–2000 (PMID 24256378, PMCID 4030388, DOI 10.1056/NEJMoa1306357)
- (en) « Common variants of the vitamin D binding protein gene and adverse health outcomes », Critical Reviews in Clinical Laboratory Sciences, vol. 50, no 1, january–february 2013, p. 1–22 (PMID 23427793, PMCID 3613945, DOI 10.3109/10408363.2012.750262)
- Henderson CM, Fink SL, Bassyouni H et al. Vitamin D–binding protein deficiency and homozygous deletion of the GC gene, N Engl J Med, 2019;380:1150-1157