Péricardite
| Symptômes | Inflammation |
|---|
| Médicament | Anakinra et (S)-(−)-colchicine |
|---|---|
| Spécialité | Cardiologie |
| CIM-10 | I01.0, I09.2, I30-I32 |
|---|---|
| CIM-9 | 420.0, 420.90, 420.91, 420.99, 423.1, 423.2 |
| DiseasesDB | 9820 |
| MedlinePlus | 000182 |
| eMedicine |
156951 emerg/412 |
| MeSH | D010493 |
Une péricardite est une inflammation du péricarde, le sac fibro-séreux translucide qui entoure le cœur. Elle peut s'accompagner ou non d'un épanchement péricardique et en cas de fibrose et calcifications (avec alors épaississement du péricarde) évoluer vers une péricardite constrictive qui gêne le fonctionnement du cœur (insuffisance cardiaque droite, qui aura aussi des effets négatifs collatéraux sur le foie).
Elle est dite « chronique » si elle n'a pas disparu après 6 mois[1].
On la distingue d'un épanchement péricardique, qui correspond à la présence de liquide dans le péricarde, sans obligatoirement d'inflammation. Ces deux phénomènes restent cependant très proches.

La figure B montre un cœur avec péricardite. L'image incrustée est une coupe transversale agrandie montrant les couches enflammées et épaissies du péricarde[2]

Épidémiologie modifier
Dans les services d'urgence, une péricardite est trouvée chez environ 5 % des patients venus pour une douleur thoracique[3]. Les 2/3 environ des victimes sont des hommes, pour un tiers de femmes[4]. Un tiers des cas est associé à une myocardite[3].
Diagnostic modifier
Clinique modifier
Typiquement, la péricardite se manifeste par une douleur thoracique :
- d'apparition brutale ou subaigüe ;
- prolongée ;
- médiane, ou latéralisée à gauche ;
- irradiant parfois à l'épaule gauche ;
- augmentée à l'inspiration, rendant difficile cette dernière ;
- beaucoup plus importante lorsque le patient est sur le dos (décubitus dorsal), relativement calmée en position assise.
Les caractères les plus constants sont la durée prolongée et la majoration à la respiration.
De façon inconstante, il peut également exister :
L'examen du patient peut montrer de manière inconstante :
- un frottement péricardique à l'auscultation cardiaque : il s'agit d'un bruit superficiel perçu lors de la systole et de la diastole, évoquant une « feuille de papier froissée » ou un « craquement de cuir neuf ». Il persiste en apnée (ce qui permet de la différencier du frottement pleural).
Des signes pouvant évoquer une forme grave (dite « compliquée ») sont à rechercher :
- une baisse de la pression artérielle ; collapsus cardiovasculaire ;
- la présence d'un œdème des membres inférieurs prenant typiquement la marque du doigt (signe du godet) lorsqu'on appuie dessus (« œdème hémodynamique ») ;
- un gros foie (hépatomégalie) douloureux (hépatalgie) qui peut indiquer une péricardite constrictive ;
- des veines jugulaires externes particulièrement apparentes au niveau du cou (turgescence jugulaire).
Un signe clinique simple — dit « signe de la prière mahométane » (sic) — peut être recherché devant une douleur thoracique augmentée à l'inspiration profonde. Il n'est pas pathognomonique de la péricardite mais il peut servir d’élément d'orientation diagnostique. Il consiste à demander au patient d'effectuer une antéflexion du tronc (assis, il se penche en avant, la tête vers les genoux), en cas de péricardite, la douleur et la dyspnée diminuent[5].
Examens complémentaires modifier
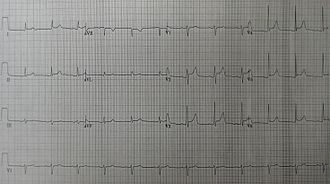
L'ECG permet d'éliminer le diagnostic d'infarctus du myocarde, autre cause de douleurs thoraciques prolongées. Il peut être normal mais il est généralement perturbé. Cet examen est à réitérer.
Le premier signe, retrouvé dans 80 % des cas, montre un sous-décalage diffus du segment PQ.
On décèle classiquement des troubles de la repolarisation avec des anomalies du segment ST diffuses évoluant en 4 stades successifs :
- stade I, dans les 24 premières heures : aspect de lésion sous-épicardique avec sus-décalage du ST concave en haut et sous-décalage du PR ;
- stade II, entre la 24e et la 48e heure : retour du segment ST à la ligne isoélectrique ; diminution de l'amplitude des ondes T qui deviennent plates (aspect « en verre de montre ») ;
- stade III, repéré avant la 1re semaine : aspect d'ischémie sous-épicardique avec des ondes T devenant négatives ;
- stade IV : retour à la normale, en deux mois maximum.
Ces anomalies sont diffuses dans toutes les dérivations et concordantes, sans image en miroir. Il existe rarement un aspect de bas voltage diffus lorsque l'épanchement est important. Il y a parfois des troubles du rythme auriculaire, fibrillation et flutter auriculaire[6].
L'échocardiographie peut retrouver un liseré sombre autour du cœur, liseré plus ou moins épais, signant la présence de liquide dans le péricarde, et donc, le diagnostic de péricardite. Si ce décollement péricarditique est visualisé, on peut en apprécier le volume et le retentissement sur les cavités cardiaques (essentiellement droites) et le septum avec la présence d'un Signe de Maurin à la recherche d'une forme sévère. Fréquemment, l'examen est strictement normal, ce qui n'élimine cependant pas le diagnostic.
L'IRM cardiaque, plus sensible que l'échographie, montre et situe une inflammation en hypersignal du péricarde. Il n'est pas cependant nécessaire en cas de péricardite banale.
Les examens biologiques montrent un syndrome inflammatoire plus ou moins important avec une augmentation de la CRP, de la vitesse de sédimentation ou des globules blancs (hyperleucocytose).
La radiographie thoracique n'est anormale que s'il existe un épanchement abondant. Elle montre alors une augmentation de taille de la silhouette cardiaque (cardiomégalie) symétrique avec un aspect en « théière » ou en « carafe ».
Causes modifier
Dans près de huit cas sur dix, aucune cause n'est identifiée[7] et l'évolution est simple. Sous réserve de l'absence de point d'appel, il est inutile de lancer alors une recherche exhaustive de la cause.
Un mécanisme auto-immun pourrait parfois être en cause et expliquer les récidives[8], certains anticorps ciblant le cœur étant retrouvés[9].
En principe, on distingue les causes infectieuses et non infectieuses.
Péricardite infectieuse modifier
- infection virale à l'un des virus coxsackie A, adénovirus, échovirus, etc. Une péricardite peut toucher des patients porteur du VIH.
- Beaucoup plus rarement une infection bactérienne (mycobactéries (tuberculose, infection dans le cadre d'une septicémie) peut causer une péricardite.
- Rarement une mycose (Candida, Aspergillus) en est la cause.
Péricardite non infectieuse modifier
- Un infarctus du myocarde peut provoquer une péricardite (pericarditis epistenocardica), dès le début, ou plusieurs semaines après. Dans le premier cas, elle témoigne de l'atteinte de toute l'épaisseur de la paroi (nécrose transmurale) et peut (rarement) être évocatrice d'un risque de rupture du cœur. Dans le second cas, il s'agit d'un phénomène inflammatoire réactionnel, non péjoratif (syndrome de Dressler) ;
- La plupart des maladies auto-immunes systémiques (lupus erythematosus, polyarthrite rhumatoïde, sarcoïdose…) peuvent se compliquer d'une péricardite ;
- Elle peut se voir en cas de réaction allergique (maladie sérique, allergie médicamenteuse) ;
- Un épaississement pathologique (doublement ou triplement d'épaisseur), associé à un épaississement des vaisseaux, sans phénomène inflammatoire semble caractéristique d'un syndrome découvert chez des personnels exposés de manière chronique (plus de 10 ans en général) à d'intenses vibrations et à des sons de basse-fréquence (dont infrasons) émis à haute intensité. Ce syndrome évoque une péricardite constructive. Il est dénommé Vibroacoustic Disease chez les anglophones et souvent maladie vibroacoustique chez les francophones. Il touche par exemple des pilotes d'avions, des personnels entretenant de gros moteurs (grands navires, bateaux de pêche, sous-marins...), des utilisateurs de tronçonneuses, marteaux-piqueurs, vibreurs à béton et autres outils très bruyants et fortement vibrants.
Épanchement péricardique modifier
Il se voit :
- en cas d'insuffisance rénale chronique ;
- après un traumatisme de la poitrine (hémopéricarde où l'épanchement est sanguin) ;
- en cas de cancer.
Dans certains cas, le bilan ne montre aucune explication. On parle alors de péricardite idiopathique.
Diagnostic différentiel modifier
ce sont les autres causes de douleur thoracique :
Forme clinique modifier
L'association d'une douleur de type péricardique avec une élévation du taux de la troponine sanguine est évocatrice d'une myopéricardite virale par atteinte simultanée du muscle cardiaque.
Traitement modifier
La prise en charge des péricardites aiguës a fait l'objet, en 2004 de recommandations par l'European Society of Cardiology[10], actualisées en 2015[11].
Une péricardite virale est traitée par :
- le repos ;
- l'aspirine (efficace dans près de 80 % des cas[12]), la colchicine avec l'aspirine est le traitement le plus rapide et avec le moins de risque de récidive [13],[14],[15], des anti-inflammatoires non stéroïdiens, des corticoïdes. Le traitement doit être prolongé au minimum jusqu'à la normalisation du syndrome inflammatoire, en général un mois. Un traitement protecteur gastrique peut être donné pour pallier la possible mauvaise tolérance digestive des fortes doses ;
- les anti-inflammatoires non stéroïdiens constituent une alternative ;
- les corticoïdes sont réservés aux formes résistantes. Ils ont l'inconvénient d'avoir un risque de rechute élevé[16]. En cas d'échec, un traitement ciblant l'interleukine 1 peut être proposé[17].
Les péricardites purulentes sont traitées par :
- un drainage chirurgical avec mise en place d'un gros drain ;
- une antibiothérapie prolongée par voie générale, adaptée au germe.
Les péricardites tuberculeuses sont traitées par :
- un traitement anti-tuberculeux classique mais prolongé pendant un an ;
- une corticothérapie dans certains cas, ce qui pourrait diminuer le risque de constriction.
Sans caractère de gravité, une hospitalisation n'est pas nécessaire[18]. De même, la recherche de la cause n'est pas systématique en l'absence de signe d'appel.
En cas de récidive, le même traitement peut être reconduit. Dans ces cas, la colchicine, donnée pendant trois mois en association avec l'aspirine, réduit significativement le risque de récidive[19]. Cette dernière molécule, donnée en plus du traitement habituel lors du premier épisode semble également améliorer les symptômes et diminuer le risque de récidive[20].
Évolution et complications modifier
L'évolution se fait, dans la majeure partie des cas, vers la guérison sans séquelles.
Elle peut cependant récidiver.
Deux complications rares doivent être recherchées
Tamponnade modifier
Il s'agit d'une compression des cavités cardiaques par le liquide sous pression dans le péricarde, empêchant ainsi le cœur de se remplir correctement.
La tamponnade se manifeste par une baisse de la pression artérielle pouvant aller jusqu'au collapsus, voire à l'arrêt cardiorespiratoire. Il s'agit d'une complication grave nécessitant la prise en charge urgente en milieu spécialisé.
On la soupçonne devant un épanchement péricardique associé à des signes de mauvaise tolérance : essoufflement (dyspnée) particulièrement marqué lorsque le patient est en position allongée, chute de la pression artérielle, veines jugulaires particulièrement apparentes (turgescence jugulaire) surtout en position assise où normalement elles ne sont dans ce cas quasiment pas visibles.
Le diagnostic est fait par l'échocardiographie qui montre un épanchement plus ou moins important dans le péricarde, et surtout, un aplatissement des cavités droites (les premières à se comprimer, la paroi des cavités gauches étant plus épaisse), une veine cave inférieure dilatée, ne variant pas avec la respiration (normalement, elle s'aplatit durant l'inspiration).
En cas de suspicion de tamponnade, le patient doit être laissé à jeun et maintenu en position assise avec une surveillance rapprochée de la tension artérielle. Une perfusion doit être posée afin d'obtenir un remplissage vasculaire correct.
Le traitement est le drainage de l'épanchement, soit chirurgical soit percutané (avec une aiguille). La chirurgie consiste en l'évacuation de l'épanchement par une incision sous la xiphoïde sternale et l'installation d'un drain (tuyau relié à un système d'aspiration permettant l'écoulement du liquide). Le chirurgien profite de l'opération pour prélever le liquide et un morceau de péricarde (biopsie) pour analyse et recherche d'une cause. Cette intervention, simple et rapide, peut être faite dans un service de chirurgie non spécialisé. La ponction à l'aiguille est faite par un cardiologue interventionnel par ponction sous-xyphoïdienne généralement sous contrôle échocardiographique.
Péricardite constrictive modifier
Il s'agit d'un épaississement des feuillets constituant le péricarde, avec éventuelles adhésions au cœur. « La rigidification et l'épaississement du péricarde altèrent fortement le remplissage ventriculaire, réduisant le volume systolique et le débit cardiaque »[1]. C'est une maladie chronique, souvent insidieuse et dont le diagnostic est difficile.
On la découvre souvent à l'occasion de douleurs abdominales droites (à l’effort au début), accompagnée de signes d'une insuffisance cardiaque droite (œdèmes des membres inférieurs, épanchements liquides dans la cavité abdominale [ ascite ]) et « gros foie » ; la pression veineuse systémiquement élevée et de la pression veineuse hépatique peuvent conduire à une « cirrhose cardiaque », le patient pouvant alors se présenter pour un bilan de cirrhose plutôt que pour un problème cardiaque[1].
Elle peut suivre assez rapidement une péricardite bénigne liquidienne. Elle apparait parfois 5 à 10 ans après la guérison d'une péricardite et semble insidieusement possible sans antécédent péricarditique. Évoluant souvent vers une fibrose avec calcification, elle peut ensuite gêner le cœur et notamment indirectement affecter le foie (mal irrigué).
Sa cause autrefois la plus fréquente était la tuberculose, mais elle est devenue rare[1] ; elle peut aussi selon certains auteurs[21] être induite par une radiothérapie, ou par l'exposition chronique à des vibrations intenses et à des ondes de basse fréquence à un niveau élevé (Maladie vibroacoustique), ou plus rarement être liée à un cancer du péricarde. Elle complique exceptionnellement une péricardite virale banale[22].
Elle se manifeste par un tableau d'insuffisance cardiaque droite : œdèmes des jambes, gros foie parfois douloureux, veines jugulaires particulièrement apparentes (« turgescentes »). Le tableau est proche d'une insuffisance cardiaque, dite restrictive.
L'échocardiographie peut montrer de manière inconstante un épaississement du péricarde avec des anomalies du remplissage cardiaque au doppler. Le scanner peut confirmer le diagnostic en démontrant l'épaississement du péricarde qui peut être généralisé ou localisé, l'examen de référence est le cathétérisme cardiaque droit qui est un examen invasif.
Le traitement est l'ablation chirurgicale du péricarde ("péricardectomie" ou "décortication"), une opération minutieuse et délicate.
Notes et références modifier
- Brian D. Hoit, fiche Péricardite, Manuel MSD (Merck and Co.), consulté le .
- « Pericarditis » [archive du ], sur nhlbi.nih.gov (consulté le )
- (en) Lewinter MM, « Acute pericarditis » N Engl J Med. 2014;371:2410-2416.
- (en) Kytö V, Sipilä J, Rautava P, « Clinical profile and influences on outcomes in patients hospitalized for acute pericarditis » Circulation 2014;130:1601-6.
- Par Jacques Quevauvilliers, Alexandre Somogyi, Abe Fingerhut. « prière mahométane (signe de la) », Dictionnaire médical, Elsevier Masson, 2007 - 1 516 pages.
- Pr Almange. « Affections du péricarde », 12 septembre 1998, www.med.univ-rennes1.fr
- (en) Zayas R, Anguita M, Torres F, Giménez D, Bergillos F, Ruiz M, Ciudad M, Gallardo A, Vallés F, « Incidence of specific etiology and role of methods for specific etiologic diagnosis of primary acute pericarditis » Am J Cardiol. 1995;75:378–382.
- (en) Brucato A, Maestroni S, Cumetti D et al. « Recurrent pericarditis: infectious or autoimmune? » Autoimmun Rev. 2008;8:44-47
- (en) Caforio AL, Brucato A, Doria A et al. « Anti-heart and anti-intercalated disk autoantibodies: evidence for autoimmunity in idiopathic recurrent acute pericarditis » Heart. 2010;96:779-784
- (en) Maisch B, Seferovic PM, Ristic AD et al. « Guidelines on the diagnosis and management of pericardial diseases executive summary: the Task Force on the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology » Eur Heart J. 2004;25:587–610.
- Adler Y, Charron P, Imazio M et al. 2015 ESC Guidelines for the diagnosis and management of pericardial diseases, Eu J Cardiol, 2015;36:2921-2964
- (en) Imazio M, Demichelis B, Parrini I et al. « Day-hospital treatment of acute pericarditis: a management program for outpatient therapy » J Am Coll Cardiol. 2004;43:1042–1046.
- (en) Massimo Imazio, Fiorenzo Gaita et Martin LeWinter, « Evaluation and Treatment of Pericarditis: A Systematic Review », JAMA, vol. 314, no 14, , p. 1498 (ISSN 0098-7484, DOI 10.1001/jama.2015.12763, lire en ligne, consulté le )
- (en) Massimo Imazio, Antonio Brucato, Roberto Cemin et Stefania Ferrua, « A Randomized Trial of Colchicine for Acute Pericarditis », New England Journal of Medicine, vol. 369, no 16, , p. 1522–1528 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMoa1208536, lire en ligne, consulté le )
- (en) Massimo Imazio, Marco Bobbio, Enrico Cecchi et Daniela Demarie, « Colchicine in Addition to Conventional Therapy for Acute Pericarditis: Results of the COlchicine for acute PEricarditis (COPE) Trial », Circulation, vol. 112, no 13, , p. 2012–2016 (ISSN 0009-7322 et 1524-4539, DOI 10.1161/CIRCULATIONAHA.105.542738, lire en ligne, consulté le )
- (en) Lotrionte M, Biondi-Zoccai G, Imazio M et al. « International collaborative systematic review of controlled clinical trials on pharmacologic treatments for acute pericarditis and its recurrences » Am Heart J. 2010;160:662–670
- Imazio M, Lazaros G, Gattorno M et al. Anti-interleukin-1 agents for pericarditis: a primer for cardiologists, Europ Heart J, 2022;43: 2946–2957
- (en) Imazio M, Spodick DH, Brucato A, Trinchero R, Adler Y, « Controversial issues in the management of pericardial diseases » Circulation 2010;121:916-928,
- (en) Imazio M, Bobbio M, Cecchi E et al. « Colchicine as first choice therapy for recurrent pericarditis » Arch Intern Med. 2005;165:1987–1991
- (en) Imazio M, Brucato A, Cemin R et al. « A randomized trial of colchicine for acute pericarditis » N Engl J Med. 2013;369:1522-1528
- Alves-Pereira M, de Melo J.J & Branco N.A.C (2005) Low frequency noise exposure and biological tissue: reinforcement of structural integrity ? In Recent Advances in Multidisciplinary Applied Physics (pp. 961-966)| résumé
- (en) Imazio M, Brucato A, Maestroni S et al. « Risk of constrictive pericarditis after acute pericarditis » Circulation 2011;124:1270-1275
