Hexasoufre
L'hexasoufre, noté S6 couramment appelé cyclohexasoufre ou hexathiane, est un allotrope du soufre de couleur orange-rouge. Dans les phases liquide et vapeur, S6 est cyclique en configuration chaise et est en équilibre avec les autres formes de soufre (notamment S8). La longueur de la liaison est de 2,057 Å. Sous forme solide, sa structure cristalline est rhomboédrique. Ce composé est relativement stable, bien qu'a température ambiante et pression atmosphérique la forme la plus stable reste S8. Il se décompose notamment en ce dernier et S12 sous le simple effet de la lumière. Son énergie de liaison est de 62.8 kcal/mol[2]. Dans S6 (comme dans S8), les atomes de soufre sont tous équivalents avec des distances interatomiques (d=205.7 pm[3]) et des angles constants (θ=102.2° et θdihédral=74.5°[3]). L'addition d'un S à une unité S3 (pour la formation de S6) se fait en conformation cis.
| Hexasoufre | |
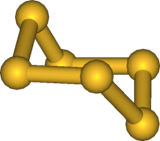
| |
| Identification | |
|---|---|
| Synonymes |
hexasoufre |
| SMILES | |
| InChI | |
| Apparence | solide ou liquide orange-rouge |
| Propriétés chimiques | |
| Formule | S6 [Isomères] |
| Masse molaire[1] | 192,39 ± 0,03 g/mol S 100 %, |
| Propriétés physiques | |
| T° fusion | 50-60 °C |
| T° ébullition | [réf. souhaitée] |
| Masse volumique | 2,209 g·cm-3 |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 10,2 eV |
| Cristallographie | |
| Système cristallin | Trigonal |
| Réseau de Bravais | Rhomboédrique |
| Structure type | . |
| Paramètres de maille | a=10,818 Å, c=4,280 Å, c/a=0,395 6[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Préparation
modifierL'hexasoufre fut pour la première fois synthétisée par Engel en 1891, par la réaction: H2S4 + S2Cl2 → S6 + 2 HCl[2].
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- http://web.gps.caltech.edu/~vijay/Papers/Chemistry/Meyer-76.pdf
- (en) N.N Greenwood, Chemistry of the elements, vol. 2, Butterworth Heinemann, Sulfur