GCaMP
GCaMP est un marqueur calcique encodé génétiquement (GECI), initialement développé par Junichi Nakai[1]. GCaMP résulte de l'assemblage d'une protéine fluorescente verte (EGFP), d'une protéine modulée par le calcium (calmoduline) et de M13, un peptide d'une kinase de la chaîne légère régulatrice de la myosine II. L'intérêt du GECI est qu'il peut être étudié dans des organismes vivants. La première souris transgénique exprimant GCaMP a été créée en 2004[2] et GCaMP a par la suite été amélioré en GCaMP2, stable à température corporelle des mammifères, permettant les premiers enregistrements de données in vivo chez les mammifères en utilisant un GECI[3]. Successivement, les GCaMPs ont été modifiés en GCaMP3[4] et GCaMP-X[5], améliorant ainsi l'amplitude de leur signal fluorescent et améliorant leur rapport signal sur bruit. Des GECIs à fluorescence rouge, nommés "RCaMPs"[6], ont également été développés pour permettre l'analyse d'images multi-spectrales[7].
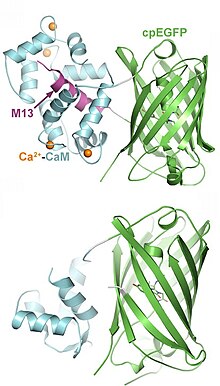
La EGFP est modifiée par permutation circulaire de telle sorte que ses domaines N- et C-terminaux sont fusionnés créant ainsi un nouveau domaine terminal au centre de la protéine. Sont ensuite fusionnés à ce nouveau domaine terminal la calmoduline et le M13. La calmoduline est une protéine capable de s'associer à quatre ions calcium grâce à ses motifs main EF. Lorsqu'elle est au contact du calcium, la calmoduline subit un changement conformationnel démasquant son site de fixation aux chaînes hélicoïdales de ses protéines cibles telles que le M13. En l'absence de calcium, la protéine EGFP circularisée n'est pas fluorescente à cause de la protonation de son chromophore par l'eau rendant son absorption aux longueurs d'onde excitatrices moindre. Le changement conformationel dû à la fixation du calcium à la calmoduline empêche cette action de l'eau, permet la déprotonation du chromophore et une fluorescence vive[8],[9].
Références
modifier- (en) Nakai J, Ohkura M, Imoto K, « A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein », Nature Biotechnology, vol. 19, no 2, , p. 137–41 (PMID 11175727, DOI 10.1038/84397, S2CID 30254550)
- (en) Ji G, Feldman ME, Deng KY, Greene KS, Wilson J, Lee JC, Johnston RC, Rishniw M, Tallini Y, Zhang J, Wier WG, Blaustein MP, Xin HB, Nakai J, Kotlikoff MI, « Ca2+-sensing transgenic mice: postsynaptic signaling in smooth muscle », The Journal of Biological Chemistry, vol. 279, no 20, , p. 21461–8 (PMID 14990564, DOI 10.1074/jbc.m401084200)
- (en) Tallini YN, Ohkura M, Choi BR, Ji G, Imoto K, Doran R, Lee J, Plan P, Wilson J, Xin HB, Sanbe A, Gulick J, Mathai J, Robbins J, Salama G, Nakai J, Kotlikoff MI, « Imaging cellular signals in the heart in vivo: Cardiac expression of the high-signal Ca2+ indicator GCaMP2 », Proceedings of the National Academy of Sciences of the United States of America, vol. 103, no 12, , p. 4753–8 (PMID 16537386, PMCID 1450242, DOI 10.1073/pnas.0509378103, Bibcode 2006PNAS..103.4753T)
- (en) Tian L, Hires SA, Mao T, Huber D, Chiappe ME, Chalasani SH, Petreanu L, Akerboom J, McKinney SA, Schreiter ER, Bargmann CI, Jayaraman V, Svoboda K, Looger LL, « Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators », Nature Methods, vol. 6, no 12, , p. 875–81 (PMID 19898485, PMCID 2858873, DOI 10.1038/nmeth.1398)
- (en) Yaxiong Yang, Nan Liu, Yuanyuan He, Yuxia Liu, Lin Ge, Linzhi Zou, Sen Song, Wei Xiong et Xiaodong Liu, « Improved calcium sensor GCaMP-X overcomes the calcium channel perturbations induced by the calmodulin in GCaMP », Nature Communications, vol. 9, no 1, , p. 1504 (ISSN 2041-1723, PMID 29666364, PMCID 5904127, DOI 10.1038/s41467-018-03719-6, Bibcode 2018NatCo...9.1504Y)
- (en) Akerboom J, Carreras Calderón N, Tian L, Wabnig S, Prigge M, Tolö J, Gordus A, Orger MB, Severi KE, Macklin JJ, Patel R, Pulver SR, Wardill TJ, Fischer E, Schüler C, Chen TW, Sarkisyan KS, Marvin JS, Bargmann CI, Kim DS, Kügler S, Lagnado L, Hegemann P, Gottschalk A, Schreiter ER, Looger LL, « Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics », Frontiers in Molecular Neuroscience, vol. 6, , p. 2 (PMID 23459413, PMCID 3586699, DOI 10.3389/fnmol.2013.00002)
- (en) Zhao Y, Araki S, Wu J, Teramoto T, Chang YF, Nakano M, Abdelfattah AS, Fujiwara M, Ishihara T, Nagai T, Campbell RE, « An expanded palette of genetically encoded Ca²⁺ indicators », Science, vol. 333, no 6051, , p. 1888–91 (PMID 21903779, PMCID 3560286, DOI 10.1126/science.1208592)
- (en) Wang Q, Shui B, Kotlikoff MI, Sondermann H, « Structural basis for calcium sensing by GCaMP2 », Structure, vol. 16, no 12, , p. 1817–27 (PMID 19081058, PMCID 2614139, DOI 10.1016/j.str.2008.10.008)
- (en) Akerboom J, Rivera JD, Guilbe MM, Malavé EC, Hernandez HH, Tian L, Hires SA, Marvin JS, Looger LL, Schreiter ER, « Crystal structures of the GCaMP calcium sensor reveal the mechanism of fluorescence signal change and aid rational design », The Journal of Biological Chemistry, vol. 284, no 10, , p. 6455–64 (PMID 19098007, PMCID 2649101, DOI 10.1074/jbc.m807657200)
