Ester de phosphite
En chimie, les esters de phosphite, organophosphites, ou par abus de langage simplement « phosphites », sont une famille de composés organophosphorés de formule P(OR)3. Ils sont considérés comme les esters de la forme tautomère jamais observée de l'acide phosphoreux, P(OH)3, le plus simple membre de la famille étant le phosphite de triméthyle, P(OCH3)3.
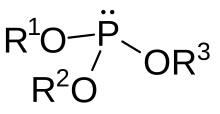

Les diorganophosphites (HP(O)(OR)2), les esters de la forme tautomère dominante de l'acide phosphoreux (HP(O)(OH)2) sont également souvent associés à cette famille. Le plus simple exemple dans ce cas est le phosphite de diméthyle, HP(O)(OCH3)2.
Les composés de ces deux classes sont en général des liquides incolores très odorants qui se décomposent violemment dans l'eau.
Synthèse
modifierÀ partir de PCl3
modifierLes esters de phosphite sont typiquement préparés par réaction entre le trichlorure de phosphore et un alcool. Selon les conditions, cette alcoolyse peut donner des diorganophosphites[1] :
- PCl3 + 3 C2H5OH → (C2H5O)2P(O)H + 2 HCl + C2H5Cl
Cependant, si cette alcoolyse est menée en présence d'un accepteur de proton, on obtient alors de dérivés trialcoxylés avec une symétrie C3[2] :
- PCl3 + 3 C2H5OH + 3 R3N → (C2H5O)3P + 3 R3NHCl
On peut préparer de nombreux dérivés de cette façon, des deux classes de phosphites.
Transestérification
modifierLes esters de phosphite peuvent aussi être préparés par transestérification, c'est-à-dire à partir d'un autre ester de phosphite en échangeant le groupe alcool par chauffage en présence d'un autre alcool[3]. Ce procédé est réversible et peut être utilisé pour des phosphites d'alkyle mixtes. Si l'alcool du phosphite est volatil, par exemple le méthanol dans le cas du phosphite de triméthyle, il peut alors être extrait par distillation au cours de la réaction, et on peut ainsi s'assurer de la transformation complète de l'ester.
Réactivité et applications
modifierLes phosphites sont oxydés en esters de phosphate :
- P(OR)3 + [O] → OP(OR)3
Cette réaction explique l'utilisation commerciale de certains esters de phosphite comme stabilisateurs dans les polymères[4].
Les phosphites sont utilisés dans la réaction de Perkow pour former des phosphonates de vinyle, ainsi que dans la réaction de Michaelis-Arbuzov pour former des phosphonates. Les phosphites d'aryle peuvent subir ces réactions et sont donc couramment utilisés comme stabilisateurs dans les polymères halogénés tels que le PVC.
Les esters de phosphite peuvent être utilisés comme réducteurs dans certains cas spécialisés. Par exemple, le phosphite de triéthyle est connu pour réduire certains hydroperoxydes en alcools formés par auto-oxydation[5]. Dans ce procédé, le phosphite est converti en ester de phosphate. Ce type de réaction est utilisé dans la synthèse totale du Taxol de Wender (en).
Catalyse homogène
modifierLes esters de phosphite sont des bases de Lewis et peuvent donc former des complexes avec de nombreux ions métalliques. On peut citer parmi ces ligands le phosphite de triméthyle ((MeO)3P), le phosphite de triéthyle ((EtO)3P), le phosphite de triméthylolpropane et le phosphite de triphényle ((PhO)3P). Les phosphites présentent un angle du cône du ligand (en) plus faible que ceux de la famille structurellement apparentée des ligands phosphine (en). Les ligands phosphite sont des composants de catalyseurs industriels utilisés dans des procédés d'hydroformylation et d'hydrocyanation[8].
Diorganophosphites
modifierLes diorganophosphites sont des derivés phosphore(V) et peuvent être vus comme des diesters de l'acide phosphoreux. Ils présentent un équilibre tautomèrique entre cette forme et une forme « phosphonate » (droite), qui est en général la forme largement dominante[9] :
- (RO)2POH ⇌ (RO)2P(O)H
La liaison P-H est le site hautement réactif de ces composés (par exemple dans la réaction d'Atherton-Todd), alors que dans les triorganophosphites, le site hautement réactif est le doublet libre du phosphore. Les diorganophosphites peuvent subir des transestérifications.
Notes et références
modifier- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Phosphite ester » (voir la liste des auteurs).
- Malowan, John E., « Diethyl phosphite », Inorganic Syntheses, vol. 4, , p. 58–60 (DOI 10.1002/9780470132357.ch19)
- A. H. Ford-Moore, Triethyl Phosphite, Org. Synth., coll. « vol. 4 », , p. 955
- Friedrich W. Hoffmann, Richard J. Ess et Robert P. Usingef, « The Transesterification of Trialkyl Phosphites with Aliphatic Alcohols », Journal of the American Chemical Society, vol. 78, no 22, , p. 5817–5821 (DOI 10.1021/ja01603a026)
- Rainer Wolf et Bansi Lal Kaul, « Plastics, Additives », dans Ullmann's Encyclopedia Of Industrial Chemistry, (DOI 10.1002/14356007.a20_459)
- J. N. Gardner, F. E. Carlon et O. Gnoj, « One-step procedure for the preparation of tertiary α-ketols from the corresponding ketones », J. Org. Chem., vol. 33, no 8, , p. 3294–3297 (DOI 10.1021/jo01272a055)
- Gregory D. Cuny et Stephen L. Buchwald, « Practical, High-Yield, Regioselective, Rhodium-Catalyzed Hydroformylation of Functionalized α-olefins », Journal of the American Chemical Society, vol. 115, no 5, , p. 2066–2068 (DOI 10.1021/ja00058a079)
- Annemiek Van Rooy, Paul C. J. Kamer, Piet W. N. M. Van Leeuwen, Kees Goubitz, Jan Fraanje, Nora Veldman et Anthony L. Spek, « Bulky Diphosphite-Modified Rhodium Catalysts: Hydroformylation and Characterization », Organometallics, vol. 15, no 2, , p. 835–847 (DOI 10.1021/OM950549K, lire en ligne)
- Aitor Gual, Cyril Godard, Verónica de la Fuente et Sergio Castillón, Phosphorus(III) Ligands in Homogeneous Catalysis: Design and Synthesis, John Wiley & Sons, (DOI 10.1002/9781118299715.ch3), « Design and Synthesis of Phosphite Ligands for Homogeneous Catalysis »
- G. O. Doak et Leon D. Freedman, « The Structure and Properties of the Dialkyl Phosphonates. », Chemical Reviews, vol. 61, no 1, , p. 31–44 (DOI 10.1021/cr60209a002)