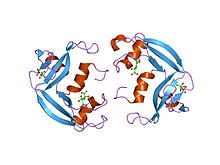
Protéine cationique des éosinophiles
La protéine cationique des éosinophiles (ECP, pour Eosinophil Cationic Protein en anglais) ou ribonucléase 3 est une enzyme basique des granulocytes éosinophiles[2]. Chez l'homme, elle est encodée par le gène RNASE3[3] situé sur le chromosome 14. Elle est libérée au cours de la dégranulation des éosinophiles. Une augmentation du taux de cette protéine est observée lors d'une inflammation et d'une crise asthme. Il existe trois formes glycosylées de l'ECP, dont la masse moléculaire est par conséquent comprise entre 18 et 22 kDa.
| N° EC | EC |
|---|
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
La protéine cationique des éosinophiles et la neurotoxine dérivée des éosinophiles qui lui est apparentée appartiennent à la famille de la ribonucléase pancréatique, ou ribonucléase A. Elles possèdent des activités neurotoxiques, helminthotoxiques et ribonucléolytiques. L'ECP se trouve dans les granules des éosinophiles[4].
Activité ribonucléase et cytotoxicité
modifierL'activité ribonucléase de l'ECP n'est pas indispensable à sa cytotoxicité[5]. En modifiant les deux résidus d'acides aminés du site actif de l'activité ribonucléase afin de les inactiver — la lysine 38 en arginine et l'histidine 128 en aspartate[6] — on observe en effet que l'ECP demeure cytotoxique tout en étant dépourvue d'activité ribonucléase. Sa production et son transport au sein des bactéries n'est pas non plus altérée par cette mutation.
L'ECP est une protéine puissamment cytotoxique capable de tuer des cellules d'épithélium de la trachée chez le cochon d'Inde[7], de leucémie chez les mammifères[8], de carcinome épidermoïde[7], de cancer du sein[9], ainsi que des bactéries et d'autres types de cellules[10].
Chez l'homme, la protéine cationique des éosinophiles est cytotoxique pour les cellules épithéliales des bronches en se liant à des protéoglycanes à sulfate d'héparane qui sont ensuite absorbés par endocytose[11].
Apoptose induite par la protéine cationique des éosinophiles
modifierDes études ont montré que la protéine cationique des éosinophiles, comme d'autres ribonucléases dont la neurotoxine dérivée des éosinophiles, induisent l'apoptose des cellules. Leur cytotoxicité sur les cellules HL60 (en) et HeLa provient d'une activité semblable à celle de la caspase 3[12]. De ce fait, les ribonucléases cytotoxiques jouent un rôle important dans la mort des cellules. Cependant, le mécanisme de l'apoptose induite par l'ECP n'est pas encore entièrement certain. D'autres études ont montré que les éosinophiles peuvent induire la mort des cellules épithéliales par apoptose et par nécrose[13].
Notes et références
modifier- (en) Goretti Mallorquí-Fernández, Joan Pous, Rosa Peracaula, Joan Aymamí, Takashi Maeda, Hiroko Tada, Hidenori Yamada, Masaharu Seno, Rafael de Llorens, F.Xavier Gomis-Rüth et Miquel Coll, « Three-dimensional crystal structure of human eosinophil cationic protein (RNase 3) at 1.75 Å resolution », Journal of Molecular Biology, vol. 300, no 5, , p. 1297-1307 (PMID 10903870, DOI 10.1006/jmbi.2000.3939, lire en ligne)
- (en) Ester Boix, Esther Carreras, Zoran Nikolovski, Claudi M. Cuchillo et M. Victòria Nogués, « Identification and characterization of human eosinophil cationic protein by an epitope-specific antibody », Journal of Leukocyte Biology, vol. 69, no 6, , p. 1027-1035 (PMID 11404391, lire en ligne)
- (en) D.M. Mastrianni, R.L. Eddy, H.F. Rosenberg, S.E. Corrette, T.B. Shows, D.G. Tenen et S.J. Ackerman, « Localization of the human eosinophil Charcot-Leyden crystal protein (Lysophospholipase) gene (CLC) to chromosome 19 and the human ribonuclease 2 (eosinophil-derived neurotoxin) and ribonuclease 3 (eosinophil cationic protein) genes (RNS2 and RNS3) to chromosome 14 », Genomics, vol. 13, no 1, , p. 240-242 (PMID 1577491, DOI 10.1016/0888-7543(92)90237-M, lire en ligne)
- (en) Kimm J. Hamann, Rosa M. Ten, David A. Loegering, Robert B. Jenkins, Mark T. Heise, Christopher R. Schad, Larry R. Pease, Gerald J. Gleich et Robert L. Barker, « Structure and chromosome localization of the human eosinophil-derived neurotoxin and eosinophil cationic protein genes: Evidence for intronless coding sequences in the ribonuclease gene superfamily », Genomics, vol. 7, no 4, , p. 535-546 (PMID 2387583, DOI 10.1016/0888-7543(90)90197-3, lire en ligne)
- (en) Helene F. Rosenberg, « Recombinant human eosinophil cationic protein — Ribonuclease activity is not essential for cytotoxicity », Journal of Biological Chemistry, vol. 270, no 14, , p. 7876-7881 (PMID 7713881, DOI 10.1074/jbc.270.14.7876, lire en ligne)
- (en) R. I. Lehrer, D. Szklarek, A. Barton, T. Ganz, K. J. Hamann et G. J. Gleich, « Antibacterial properties of eosinophil major basic protein and eosinophil cationic protein », Journal of Immunology, vol. 142, no 12, , p. 4428-4434 (PMID 2656865, lire en ligne)
- (en) Shinji Motojima, Evangelo Frigas, David A. Loegering et Gerald J. Gleich, « Toxicity of Eosinophil Cationic Proteins for Guinea Pig Tracheal Epithelium In Vitro », American Review of Respiratory Disease, vol. 139, no 3, , p. 801-805 (PMID 2923379, DOI 10.1164/ajrccm/139.3.801, lire en ligne)
- (en) Shahina Ali, Jaswinder Kaur et Kamala D. Patel, « Intercellular Cell Adhesion Molecule-1, Vascular Cell Adhesion Molecule-1, and Regulated on Activation Normal T Cell Expressed and Secreted Are Expressed by Human Breast Carcinoma Cells and Support Eosinophil Adhesion and Activation », American Journal of Pathology, vol. 157, no 1, , p. 313-321 (PMID 10880401, PMCID 1850201, DOI 10.1016/S0002-9440(10)64542-7, lire en ligne)
- (en) P. Venge, « Monitoring the allergic inflammation », Allergy, vol. 59, no 1, , p. 26-32 (PMID 14674929, DOI 10.1046/j.1398-9995.2003.00386.x, lire en ligne)
- (en) Tan-Chi Fan, Hao-Teng Chang, I-Wen Chen, Hsiu-Yiu Wang et Margaret Dah-Tsyr Chang, « A heparan sulfate-facilitated and raft-dependent macropinocytosis of eosinophil cationic protein », Traffic, vol. 8, no 12, , p. 1778-1795 (PMID 17944807, DOI 10.1111/j.1600-0854.2007.00650.x, lire en ligne)
- (en) Axel Trautmann, Peter Schmid-Grendelmeier, Katja Krüger, Reto Crameri, Mübeccel Akdis, Ahmet Akkaya, Eva-B. Bröcker, Kurt Blaser et Cezmi A. Akdis, « T cells and eosinophils cooperate in the induction of bronchial epithelial cell apoptosis in asthma », Journal of Allergy and Clinical Immunology, vol. 109, no 2, , p. 329-337 (PMID 11842305, DOI 10.1067/mai.2002.121460, lire en ligne)