Procédé au cumène
Le procédé au cumène, ou procédé au cumène-phénol, ou encore procédé Hock, est un procédé industriel de production de phénol C6H5OH et d'acétone CH3COCH3 à partir du benzène C6H6 et du propylène CH3–CH=CH2. Il a été découvert en 1944 par Heinrich Hock[1] et peut-être de façon indépendante dès 1942 par R. Ūdris et P. Sergeyev en URSS[2]. Son nom provient du cumène, de formule C6H5CH(CH3)2, produit intermédiaire de cette synthèse.
Ce procédé convertit deux composés relativement bon marché, le benzène et le propylène, en deux produits industriels majeurs, le phénol et l'acétone. Il utilise l'oxygène O2 de l'air et de petites quantités d'un amorceur radicalaire. L'essentiel de la production mondiale d'acétone et de phénol repose de nos jours sur cette méthode ; près de 7 millions de tonnes de phénol étaient produits en 2003 par ce procédé[3].

Dans ce procédé, le benzène et le propylène sont comprimés ensemble à une pression de 30 atm et à une température de 250 °C en présence d'un acide de Lewis servant de catalyseur. L'acide phosphorique H3PO4 est souvent préféré aux halogénures d'aluminium(III) AlX3. Il commence par se former du cumène par réaction de Friedel-Crafts entre le benzène C6H6 et le propylène CH3–CH=CH2 :

L'air oxyde le cumène en éliminant son hydrogène tertiaire benzylique, ce qui donne un radical cumène :
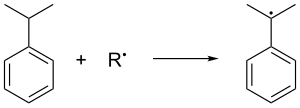
Ce radical cumène se lie ensuite avec une molécule d'oxygène pour donner le radical hydroperoxyde de cumène C6H5C(CH3)2OO•. Ce radical est converti en molécule d'hydroperoxyde de cumène C6H5C(CH3)2OOH par capture de l'hydrogène tertiaire benzylique d'une autre molécule de cumène, laquelle est convertie en radical cumène :
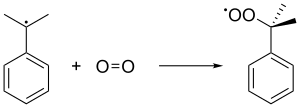

On maintient pendant ces réactions une pression de 5 atm afin de s'assurer que l'hydroperoxyde de cumène, instable, demeure liquide.
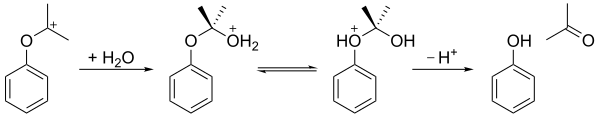
L'hydroperoxyde de cumène est ensuite hydrolysé en milieu acide — réarrangement de Hock — pour donner de l'acétone et du phénol. L'acide sulfurique H2SO4 est traditionnellement utilisé pour acidifier le milieu réactionnel, mais on a montré en 2009 que la bentonite acidifiée, une argile colloïdale, est un catalyseur meilleur marché pour y parvenir. La première étape consiste à protoner l'atome d'oxygène terminal de l'hydroperoxyde. Par la suite, le groupe phényle migre du carbone benzylique vers l'atome d'oxygène adjacent avec élimination d'une molécule d'eau, produisant un carbocation tertiaire stabilisé par mésomérie. Le mécanisme de cette étape est semblable à celui de l'oxydation de Baeyer-Villiger ainsi qu'à l'étape d'oxydation de l'hydroboration.

Le carbocation qui en résulte est ensuite attaqué par l'eau, puis un proton est transféré de l'atome d'oxygène du groupe hydroxyle vers l'atome d'oxygène du groupe éther, et enfin l'ion est clivé en phénol et acétone :
Notes et références modifier
- (de) Heinrich Hock et Shon Lang, « Autoxydation von Kohlenwasserstoffen, IX. Mitteil.: Über Peroxyde von Benzol-Derivaten », Berichte der deutschen chemischen Gesellschaft, vol. 77, nos 3-4, , p. 257-264 (lire en ligne) DOI 10.1002/cber.19440770321
- (en) Rudolfs UDRIS sur un site letton
- (en) Manfred Weber, Markus Weber et Michael Kleine-Boymann, « Phenol », Ullmann's Encyclopedia of Industrial Chemistry, (lire en ligne) DOI 10.1002/14356007.a19_299.pub2