Oxydosqualène cyclase
Une oxydosqualène cyclase est une isomérase qui convertit le 2,3-oxydosqualène en stérols et triterpènes à travers une réaction de cyclisation[1].
-
Structure du 2,3-oxydosqualène.
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Il existe de deux groupes d'oxydosqualène cyclases :
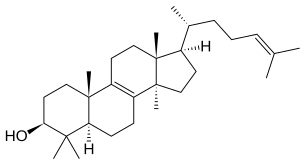
- Les cycloarténol synthases, présentes chez toutes les plantes, et qui produisent avant tout du cycloarténol ;
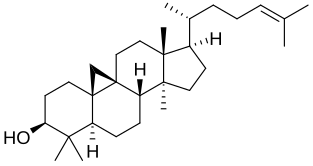
- les lanostérol synthases, présentes chez tous les animaux et les mycètes, chez certaines plantes également, et qui produisent avant tout du lanostérol.
-
Structure du cycloarténol.
-
Structure du lanostérol.
Les stérols et les triterpènes sont des classes de composés naturels très diversifiées, notamment chez les plantes, qui contiennent généralement de nombreuses oxydosqualène oxydases présentant des spécificités variées en matière de substrats et de produits de réaction. La lupéol synthase et la β-amyrine synthase[2] sont des exemples d'oxydosqualène cyclases. Le mécanisme réactionnel catalysé par ces enzymes est semblable à celui des squalène-hopène cyclases des procaryotes[3]. On a pu identifier, à l'aide de techniques d'évolution dirigée et d'ingénierie des protéines (en), un petit nombre de mutations ponctuelles qui altèrent la spécificité du produit des oxydosqualène cyclases, particulièrement en faisant que des cycloarténol synthases produisent essentiellement du lanostérol[4].
Une oxydosqualène cyclase est une enzyme monomérique. Son site actif est formé de deux domaines en tonneau[5]. Il est constitué essentiellement de résidus d'acides aminés acides chez la plupart des organismes étudiés[6]. Les résidus du site actif favorisent le repliement des oxydosqualène cyclases afin de lui donner une forme épousant les contours de son produit de réaction[5]. Ceci est déterminant pour préparer le substrat à sa cyclisation.
Notes et références
modifier- (en) Ramesha Thimmappa, Katrin Geisler, Thomas Louveau, Paul O'Maille et Anne Osbourn, « Triterpene Biosynthesis in Plants », Annual Review of Plant Biology, vol. 65, , p. 225-257 (PMID 24498976, DOI 10.1146/annurev-arplant-050312-120229, lire en ligne)
- (en) Satoru Sawai, Tomoyoshi Akashi, Nozomu Sakurai, Hideyuki Suzuki, Daisuke Shibata, Shin-ichi Ayabe et Toshio Aoki, « Plant Lanosterol Synthase: Divergence of the Sterol and Triterpene Biosynthetic Pathways in Eukaryotes », Plant & Cell Physiology, vol. 47, no 5, , p. 673-677 (PMID 16531457, DOI 10.1093/pcp/pcj032, lire en ligne)
- (en) K. Ulrich Wendt, Karl Poralla et Georg E. Schulz, « Structure and Function of a Squalene Cyclase », Science, vol. 277, no 5333, , p. 1811-1815 (PMID 9295270, DOI 10.1126/science.277.5333.1811, lire en ligne)
- (en) Silvia Lodeiro, Tanja Schulz-Gasch et Seiichi P. T. Matsuda, « Enzyme Redesign: Two Mutations Cooperate to Convert Cycloartenol Synthase into an Accurate Lanosterol Synthase », Journal of the American Chemical Society, vol. 127, no 41, , p. 14132-14133 (PMID 16218577, DOI 10.1021/ja053791j, lire en ligne)
- (en) Murray W Huff et Dawn E Telford, « Lord of the Rings--The Mechanism for Oxidosqualene:lanosterol Cyclase Becomes Crystal Clear », Trends in Pharmacological Sciences, vol. 26, no 7, , p. 335-340 (PMID 15951028, DOI 10.1016/j.tips.2005.05.004, lire en ligne)
- (en) Vitor Won-Held Rabelo, Nelilma Correia Romeiro et Paula Alvarez Abreu, « Design Strategies of Oxidosqualene Cyclase Inhibitors: Targeting the Sterol Biosynthetic Pathway », The Journal of Steroid Biochemistry and Molecular Biology, vol. 171, , p. 305-317 (PMID 28479228, DOI 10.1016/j.jsbmb.2017.05.002, lire en ligne)