Motif de reconnaissance de l'ARN
Le motif de reconnaissance de l'ARN ou RRM (de RNA recognition motif en anglais )[1],[2],[3] est un domaine protéique d'environ 90 acides aminés de long et qui est présent dans de nombreuses protéines eucaryotes connues pour fixer de l'ARN simple-brin[4],[5],[6]. On le trouve en particulier dans plusieurs protéines participant aux petites ribonucléoprotéines nucléaires (snRNPp) du splicéosome et dans la Poly(A)-binding protein.
| Pfam | PF00076 |
|---|---|
| Clan Pfam | CL0221 |
| InterPro | IPR000504 |
| PROSITE | PDOC00030 |
| SCOP | 1sxl |
| SUPERFAMILY | 1sxl |
Ces domaines contiennent un motif conservé de huit acides aminés appelé séquence consensus RNP-1[7],[8].
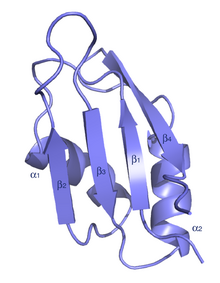
Les domaines RRM typiques se composent de quatre feuillets bêta antiparallèles et de deux hélices alpha disposés dans un motif en β-α-β-β-α-β avec des chaînes latérales qui s'empilent sur les bases de l'ARN. Une troisième hélice se forme parfois lors de l'interaction avec l'ARN[9].
Voir aussi
modifierNotes et références
modifier- « RNA recognition: towards identifying determinants of specificity », Trends Biochem. Sci., vol. 16, no 6, , - (PMID 1716386, DOI 10.1016/0968-0004(91)90088-d)
- « The RNA recognition motif, a plastic RNA-binding platform to regulate post-transcriptional gene expression », FEBS J, vol. 272, no 9, , - (PMID 15853797, DOI 10.1111/j.1742-4658.2005.04653.x)
- « Structural basis for recognition and sequestration of UUU(OH) 3' temini of nascent RNA polymerase III transcripts by La, a rheumatic disease autoantigen », Mol. Cell, vol. 21, no 1, , - (PMID 16387655, DOI 10.1016/j.molcel.2005.10.027)
- « Heterogeneous nuclear ribonucleoprotein particles and the pathway of mRNA formation », Trends Biochem. Sci., vol. 13, no 3, , p. 86–91 (PMID 3072706, DOI 10.1016/0968-0004(88)90046-1)
- « Genomic structure and amino acid sequence domains of the human La autoantigen », J. Biol. Chem., vol. 263, no 34, , - (PMID 3192525)
- « A single domain of yeast poly(A)-binding protein is necessary and sufficient for RNA binding and cell viability », Mol. Cell. Biol., vol. 7, no 9, , - (PMID 3313012, PMCID 367964)
- « RNA-binding proteins as developmental regulators », Genes Dev., vol. 3, no 4, , p. 431–437 (PMID 2470643, DOI 10.1101/gad.3.4.431)
- « A common RNA recognition motif identified within a defined U1 RNA binding domain of the 70K U1 snRNP protein », Cell, vol. 57, no 1, , - (PMID 2467746, DOI 10.1016/0092-8674(89)90175-X)
- « Analysis of the RNA-recognition motif and RS and RGG domains: conservation in metazoan pre-mRNA splicing factors », Nucleic Acids Res., vol. 21, no 25, , p. 5803–5816 (PMID 8290338, PMCID 310458, DOI 10.1093/nar/21.25.5803)