Géométrie moléculaire en forme de T
En chimie, la géométrie moléculaire en forme de T décrit les structures de certaines molécules où un atome central possède trois atomes, groupes d'atomes ou ligands. Ordinairement, les composés à trois coordonnées adoptent des géométries moléculaires planes trigonales ou pyramidales trigonales.
| Géométrie moléculaire en forme de T | |
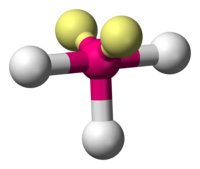
| |
| Notation VSEPR | AX3E2 |
|---|---|
| Exemple(s) | ClF3 |
| Symétrie moléculaire | C2v |
| Nombre stérique | 5 |
| Coordinence | 3 |
| Doublet non liant | 2 |
| μ (Polarité) | > 0 |
| Angle de liaison | 90°, 180° |
| modifier |
|
Des exemples de molécules en forme de T sont les trifluorures d'halogènes, tels que le ClF3[1].
La géométrie en forme de T est obtenue lorsque trois ligands, notés X, et deux paires d'électrons isolées, notés E, sont liés à un atome central, noté A. Ce type de composés appartient à la classe AX3E2 selon la théorie VSEPR.
La géométrie en forme de T est liée à la géométrie moléculaire bipyramidale trigonale pour les molécules AX5 à trois ligands équatoriaux et deux axiaux. Dans une molécule AX3E2, les deux paires isolées occupent deux positions équatoriales et les trois atomes de ligand occupent les deux positions axiales et une position équatoriale. Les trois atomes se lient à un angle de 90° d'un côté de l'atome central, produisant la forme en T[2].
Notes et références
modifier- N. N. Greenwood et A. Earnshaw, Chemistry of the Elements, Oxford, Butterworth-Heinemann, (ISBN 0-7506-3365-4)
- Housecroft, C. E.; Sharpe, A. G. (2004). Inorganic Chemistry (2nd ed.). Prentice Hall. p. 47. (ISBN 978-0130399137).
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « T-shaped molecular geometry » (voir la liste des auteurs).