Cyanure de diéthylaluminium
Le cyanure de diéthylaluminium, ou réactif de Nagata, est un composé organométallique de formule chimique ((CH3CH2)2AlCN)n. Il s'agit d'une substance incolore généralement manipulée en solution dans le toluène. Il est utilisé pour l'hydrocyanation des cétones α,β-insaturées[3],[4],[5],[6].
| Cyanure de diéthylaluminium | |||
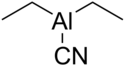
| |||
| Structure du cyanure de diéthylaluminium | |||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.024.873 | ||
| No CE | 227-359-8 | ||
| PubChem | 16683962 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C5H10AlN |
||
| Masse molaire[1] | 111,121 1 ± 0,004 9 g/mol C 54,04 %, H 9,07 %, Al 24,28 %, N 12,6 %, |
||
| Propriétés physiques | |||
| Masse volumique | 0,864 g·cm-3[2] à 25 °C | ||
| Précautions | |||
| SGH[2] | |||
| H225, H304, H311, H315, H336, H361d, H373, H410, EUH032, P201, P210, P273, P280, P302 et P304+P340+P310 |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Préparation
modifierLe cyanure de diéthylaluminium était initialement produit en traitant du triéthylaluminium (CH3CH2)6Al2 avec un léger excès de cyanure d'hydrogène HCN :
- n (CH3CH2)6Al2 + 2n HCN ⟶ 2 ((CH3CH2)2AlCN)n + 2n CH3CH3.
Le produit est généralement stocké dans des ampoules fermées car il est hautement toxique. Il se dissout dans le toluène, le benzène, l'hexane et l'éther diisopropylique. Il s'hydrolyse rapidement dans l'eau et n'est pas compatible avec les solvants protiques.
Structure
modifierLe cyanure de diéthylaluminium n'a pas été cristallographié par rayons X bien que d'autres cyanures de diorganoaluminium l'ont été. Ces derniers présentent une formule générale (R2AlCN)n et existent sous forme de trimères ou de tétramères cycliques (n = 3 ou 4, respectivement). Ces oligomères ont des liaisons AlCN–Al.
Le cyanure de bis[di(triméthylsilyl)méthyl]aluminium (((CH3)3Si)2CH)2AlCN est semblable au cyanure de diethylaluminium. Son analyse cristallographique montre qu'il est trimérique avec la structure suivante[4] :
.
Le cyanure de bis(tert-butyl)aluminium ((CH3)3C)2AlCN existe sous forme tétramérique en phase cristallisée[7],[8] :
Applications
modifierLe cyanure de diéthylaluminium est utilisé pour la réaction de Nagata, notamment l'hydrocyanation stœchiométrique des cétones α,β-insaturées. La réaction dépend de la basicité du solvant en raison du caractère acide du réactif[9]. Le but de cette réaction est de produire des alkylnitriles, qui sont précurseurs d'amines, d'amides, d'esters d'acides carboxyliques et d'aldéhydes.
-
Exemple d'hydrocyanation.
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Diethylaluminum cyanide solution 1.0 M in toluene, consultée le 7 mars 2021.
- (en) Wataru Nagata et Mitsuru Yoshioka, « Alkylaluminum cyanides as potent reagents for hydrocyanation », Tetrahedron Letters, vol. 7, no 18, , p. 1913-1918 (DOI 10.1016/S0040-4039(00)76271-X, lire en ligne)
- (de) Werner Uhl, Uwe Schütz, Wolfgang Hiller et Maximilian Heckel, « Synthese und Kristallstruktur des trimeren [(Me3Si)2CH]2Al–CN », Zeitschrift für anorganische und allgemeine Chemie, vol. 621, no 5, , p. 823-828 (DOI 10.1002/zaac.19956210521, lire en ligne)
- (en) K. Wade et B. K. Wyatt, « Reactions of organoaluminium compounds with cyanides. Part III. Reactions of trimethylaluminium, triethylaluminium, dimethylaluminium hydride, and diethylaluminium hydride with dimethylcyanamide », Journal of the Chemical Society A: Inorganic, Physical, Theoretical, vol. 1969, , p. 1121-1124 (DOI 10.1039/J19690001121, lire en ligne)
- (en) G. E. Coates et R. N. Mukherjee, « 35. Dimethylaluminium cyanide and its gallium, indium, and thallium analogues; beryllium and methylberyllium cyanide », Journal of the Chemical Society (Resumed), vol. 1963, , p. 229-233 (DOI 10.1039/JR9630000229, lire en ligne)
- (en) Werner Uhl et Madhat Matar, « Hydroalumination of Nitriles and Isonitriles », Zeitschrift für Naturforschung, vol. 59, , p. 1214-1222 (lire en ligne)
- (en) Klaus Knabel et Heinrich Nöth, « Synthesis and Structures of Some Aluminum Pseudohalides », Zeitschrift für Naturforschung, vol. 60, , p. 155-163 (lire en ligne)
- (en) W. Nagata et M. Yoshioka, « Diethylaluminum cyanide », Organic Syntheses, vol. 52, , p. 90 (DOI 10.15227/orgsyn.052.0090, lire en ligne)





