Carbonate de diphényle
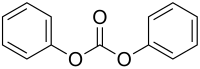
Le carbonate de diphényle est un composé organique de formule (C6H5O)2CO. Comme son nom l'indique, c'est l'ester de diphényle de l'acide carbonique. Il est principalement utilisé comme comonomère avec le bisphénol A pour former certains polymères polycarbonate[4],[5]. Il est d'ailleurs un produit de décomposition de certains polycarbonates[6].
| Carbonate de diphényle | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom systématique | carbonate de diphényle | |
| Synonymes |
carbonate de phényle |
|
| No CAS | ||
| No ECHA | 100.002.733 | |
| No CE | 203-005-8 | |
| PubChem | 7597 | |
| SMILES | ||
| InChI | ||
| Apparence | écailles blanches inodores[1] | |
| Propriétés chimiques | ||
| Formule | C13H10O3 |
|
| Masse molaire[2] | 214,216 7 ± 0,012 g/mol C 72,89 %, H 4,71 %, O 22,41 %, |
|
| Propriétés physiques | ||
| T° fusion | 78,8 °C[1] | |
| T° ébullition | 302 °C[1] | |
| Solubilité | 13 mg·L-1 (eau, 20 °C)[1] | |
| Masse volumique | 1,27 g·cm-3 (14 °C)[1] | |
| T° d'auto-inflammation | 620 °C[1] | |
| Point d’éclair | 168 °C (coupelle fermée)[1] | |
| Précautions | ||
| SGH[1] | ||
| H302, H411, P273, P280 et P301+P312 |
||
| Transport[1] | ||
| Écotoxicologie | ||
| DL50 | 1 500 mg·kg-1 (rat, oral)[3] | |
| LogP | 3,28[1] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Propriétés
modifierLe carbonate de diphényle se présente sous la forme d'écailles blanches inodore. Il est pratiquement insoluble dans l'eau (1,27 g·cm-3). Il est combustible, mais très faiblement inflammable. Il présente des risques aigus ou chronique pour la santé, et est dangereux pour la vie aquatique.
Production
modifierEn 2002, la production mondiale de carbonate de diphényle était de 254 000 tonnes, l'essentiel étant produit par phosgénation du phénol[7] :
L'utilisation de phosgène peut être évitée en effectuant à la place une carbonylation oxydante du phénol avec le monoxyde de carbone[4] :
- 2 PhOH + CO + [O] → PhOCO2Ph + H2O
Enfin, il est également possible de transestérifier le carbonate de diméthyle avec le phénol :
- CH3OCO2CH3 + 2 PhOH → PhOCO2Ph + 2 MeOH
La cinétique et la thermodynamique de cette réaction sont cependant défavorables. Par exemple, à haute température, le carbonate de diméthyle tend plutôt à méthyler le phénol en anisole[4].
Applications
modifierLe carbonate de diphényle est principalement utilisé dans la production de polycarbonates par transestérification avec le bisphénol A, produisant aussi du phénol. Cette réaction est particulièrement intéressante car elle permet d'éviter l'utilisation du phosgène hautement toxique[8]. Ces polycarbonates peuvent ensuite être recyclés en inversant le procédé : transestérifier le polycarbonate avec le phénol pour donner du carbonate de diphényle et di bisphénol A[4].
Notes et références
modifier- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Diphenyl carbonate » (voir la liste des auteurs).
- Entrée du numéro CAS « 102-09-0 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais) (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- National Technical Information Service. Vol. OTS0540144
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a05_197/full), « Carbonic Esters »
- Harold Wittcoff, B. G. Reuben et Jeffrey S. Plotkin, Industrial Organic Chemicals, Wiley-IEEE, (réimpr. cation-place), 278 p. (ISBN 978-0-471-44385-8, lire en ligne)
- ASM International, Characterization and Failure Analysis of Plastics, ASM International, , 369 p. (ISBN 978-0-87170-789-5, lire en ligne)
- « Diphenyl Carbonate », IPSC Inchem (consulté le )
- Zu-hua Fu, Yoshio Ono, « Two-step synthesis of diphenyl carbonate from dimethyl carbonate and phenol using MoO3/SiO2 catalysts », Journal of Molecular Catalysis A: Chemical, vol. 118, , p. 293–299 (DOI 10.1016/S1381-1169(96)00409-8)


