Énantiomérie
L’énantiomérie est une propriété de certaines molécules stéréoisomères, dont deux des isomères sont l'image l'un de l'autre dans un miroir plan, mais ne sont pas superposables. Une molécule ayant deux énantiomères est dite chirale. En revanche si une molécule est identique à sa propre image dans un miroir, elle est dite achirale. La chiralité peut être due :
- à un centre stéréogène, comme un atome substitué asymétriquement (avec quatre substituants différents), qui est souvent un atome de carbone ;
- ou à un axe de chiralité ;
- ou à un plan de chiralité.
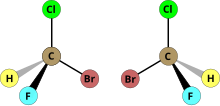

Dans le cas d'un centre stéréogène, la configuration autour de ce centre est indiquée par les lettres R ou S, selon les règles de la nomenclature Cahn-Ingold-Prelog. Dans le cas d'une chiralité de type hélicoïdale, la nomenclature Δ, Λ est souvent utilisée.
Domaines d'application
modifierEn chimie
modifierChimiquement, deux énantiomères ont des réactivités identiques avec d'autres molécules non chirales. Ils ont les mêmes propriétés physiques et un pouvoir rotatoire opposé.
En biologie
modifierAu niveau biologique, les deux énantiomères d'une molécule, un médicament par exemple, peuvent avoir des effets physiologiques différents, voire antagoniques. Cela s'explique par le fait que les systèmes biologiques dépendent directement de la forme de la molécule. Ils sont eux-mêmes énantiopurs et interagissent différemment avec les deux énantiomères d'un centre chiral externe, où les interactions sont diastéréomériques.
Les relations entre les activités biologiques de chaque stéréoisomère pur et celles de leurs mélanges sont souvent très complexes et leur analyse nécessite des études approfondies et détaillées. Cependant, il arrive que deux énantiomères aient des activités similaires au niveau biologique.
Un exemple tragique d'effets différents de deux énantiomères est celui de la thalidomide. Cette substance utilisée dans différents médicaments possède en effet deux énantiomères. La configuration (R) de la molécule a des effets sédatifs et anti-nauséeux (notamment chez la personne enceinte), tandis que la configuration (S) a des effets tératogènes. L'utilisation de la thalidomide a donné lieu à un important scandale sanitaire au début des années 1960. On dénombre en effet entre 10 000 et 20 000 victimes[1].
En pharmaceutique
modifierL'analyse et la séparation des énantiomères (qui forment la structure spatiale et fonctionnelle de notre environnement biotique et abiotique) sont capitales pour l'avancée des recherches dans la plupart des domaines scientifiques.
Près des 2/3 des molécules biologiquement actives chirales issues de synthèse classique (non énantiosélective) proviennent de dédoublements (séparation d'énantiomères), qui représentent l'une des principales voies d'accès aux composés énantiomériquement purs. La production des produits énantiopurs représentait aux États-Unis, en 1995, la somme colossale de près de 60 milliards de dollars.
Pour ces molécules, on appelle dans le vocabulaire pharmaceutique « eutomère » l'énantiomère le plus actif quant à l'effet recherché, l'autre étant appelé « distomère ». Ce dernier peut être moins actif, inactif, ou avoir un effet totalement différent, éventuellement indésirable[2]. Dans le meilleur des cas c'est une charge que le foie devra métaboliser en plus du principe actif. Il arrive parfois que chaque énantiomère ait un intérêt pharmaceutique : par exemple le propoxyphène-(R) est un analgésique, commercialisé sous le nom de Darvon, et son énantiomère-(S) est un antitussif, vendu sous le nom en miroir de Novrad[3].
Caractérisation
modifierNomenclature
modifierIl existe trois sortes de nomenclature permettant de différencier les énantiomères : R/S, D/L et +/-. Les règles apparaissent à la page Chiralité.
Quantité
modifierPour une molécule donnée, il existe au maximum 2n isomères optiques pour un composé avec n centres stéréogènes, car il faut également tenir compte du fait que l'on puisse, lors de la recherche d'isomères optiques, trouver deux, trois, voire quatre fois le même stéréoisomère.
Résolution chirale
modifierLe premier exemple de résolution chirale (séparation d'énantiomères) est celui de Louis Pasteur qui, en 1848, isola les deux énantiomères de l'acide tartrique par tri manuel de cristaux énantiomorphes.
De nouvelles techniques et méthodes effectuant le dédoublement des racémates sont depuis apparues.
Méthodes chimiques
modifierCes méthodes font appel aux diastéréoisomères, préparés à partir de racémiques par formation de sels ou par dérivation avec des composés énantiopurs, puis séparés par cristallisation ou chromatographie, ou par transformations stéréosélectives.
Plusieurs méthodes chromatographiques sont utilisées pour la séparation chirale d'une large variété de composés. Dans ce processus, les positions de l'équilibre entre les états liés et non liés sont différentes pour les deux énantiomères. Ceci est la base de la séparation.
L'utilisation d'une colonne à phase stationnaire chirale ou d'additifs chiraux dans la phase mobile est une voie plus « élégante » de séparation des énantiomères que par synthèse de composés diastéréoisomères à l'aide d'un réactif optiquement pur. Parmi les approches permettant l'obtention de substances optiquement pures, la chromatographie en phase supercritique (SFC) est de loin la méthode la plus utilisée pour la discrimination des énantiomères[4]. Les cyclodextrines, notamment, sont des phases stationnaires chirales utilisées aussi en séparation énantiomérique par d'autres méthodes telles que l'électrophorèse capillaire, la CPG et l'HPLC. Elles sont aussi employées en résonance magnétique nucléaire (RMN) comme auxiliaires chiraux pour la détermination d'excès énantiomérique. La formation des composés d'inclusion et ses applications en séparation chirale sont mises à profit dans le domaine, mais aussi dans les industries chimiques et agroalimentaires (cas du menthol ou de la mélisse).[pas clair]
Méthodes biologiques
modifierCes méthodes consistent à utiliser des enzymes qui sont des composés qui catalysent des transformations stéréospécifiques. Par exemple pour séparer les deux énantiomères du 1,1'-bi-2-naphtol, une méthode consiste à le faire réagir avec du chlorure de pentanoyle, le chlorure de l'acide pentanoïque (CH3(CH2)3COCl), pour former le di-ester. L'enzyme cholestérol estérase est alors introduite sous forme de poudre acétonique de pancréas bovin qui est capable d'hydrolyser le di-ester (S) mais pas le di-ester (R)[5]. Le dipropanoate (R) est hydrolysé dans une seconde étape avec le méthoxyde de sodium (CH3ONa)[6].
Références
modifier- Jérôme Janicki, Le drame de la thalidomide : un médicament sans frontières, 1956-2009, Paris, Éditions L'Harmattan, coll. « Acteurs de la science », , 280 p. (ISBN 978-2-296-08968-6, OCLC 497004808, BNF 41494914, lire en ligne), p. 8-9.
- Vocabulaire de la chimie pharmaceutique, Journal officiel de la République française.
- Paul Depovere, La Fabuleuse Histoire des bâtisseurs de la chimie moderne, Bruxelles, éditions De Boeck, , 2e éd., 170 p. (ISBN 978-2-8041-7564-1), p. 70.
- Syame Khater, Rationalisation des procédures de séparation des composés chiraux à visées pharmaceutique et cosmétique, Chimie analytique, université d'Orléans, 2014, NNT : 2014RLE2060.
- Dongwei Cai, David L. Hughes, Thomas R. Verhoeven et Paul J. Reider, Resolution of 1,1'-bi-2-naphthol, Organic Syntheses, Coll. vol. 10, p. 93, vol. 76, p. 1.
- Romas J. Kazlauskas, (S)-(−)- And (R)-(+)-1,1'-bi-2-naphthol, Organic Syntheses, Coll. vol. 9, p. 77, vol. 70, p. 60.