Tungstate
Un tungstate est un composé chimique qui contient un oxoanion de tungstène ou qui est un oxyde mixte contenant du tungstène. L'ion tungstate le plus simple est WO42−, "orthotungstate"[1]. Beaucoup d'autres tungstates appartiennent à une grande famille d'ions polyatomiques qui sont appelés polyoxométallates ("POMs"), et plus précisément appelés isopolyoxométallates lorsqu'ils ne contiennent, en dehors de l'oxygène et parfois de l'hydrogène, qu'un seul autre élément. Presque tous les minerais de tungstène exploitables sont des tungstates[2].
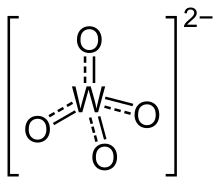
Structures
modifierLes orthotungstates possèdent des centres tétraédriques W(VI) avec de faibles distances W–O de 1.79 Å. Structurellement, ils ressemblent aux sulfates. Le tunsgtène à coordination octaédrique prévaut dans les polyoxotungstates. Dans ces composés, les distances W–O sont plus élevées[1].
Quelques exemples d'ions tungstate[3] :
- HWO4− (hydrogénotungstate)[3]
- ions polymériques W2O72− de structures variées dans Na2W2O7, Li2W2O7 et Ag2W2O7[4]
- [W7O24]6− (paratungstate A)[3]
- [W10O32]4− (tungstate Y)[5]
- [H2W12O42]10− (paratungstate B) [3]
- α-[H2W12O40]6− (métatungstate)[5]
- β-[H2W12O40]6− (tungstate X)[5]
Voir la catégorie tungstate pour une liste de tungstates.
Occurrence naturelle
modifierLes tungstates se trouvent naturellement avec les molybdates. La scheelite, le minéral tungstate de calcium, contient souvent de petites quantités de molybdate. La wolframite est le tungstate de manganèse et de fer, et tous ces minéraux sont des sources importantes de tungstène. La powellite est une forme minérale de molybdate de calcium contenant une petite quantité de tungstate.
Réactions
modifierLes solutions de tungstates, comme celles de molybdates, donnent des solutions intensément bleues de tungstate(V,VI) complexe analogues au bleu de molybdène lorsqu'elles sont réduites par des composés organiques[1].
Contrairement aux chromates et dichromates, les tungstates ne sont pas de bons oxydants, mais comme les chromates, les solutions de tungstate condensent pour former des isopolytungstates par acidification.
Références
modifier- Egon Wiberg, Arnold Frederick Holleman, Inorganic Chemistry, Elsevier, (ISBN 0-12-352651-5)
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a27_229), « Tungsten, Tungsten Alloys, and Tungsten Compounds »
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, Butterworth-Heinemann (en), , 2e éd. (ISBN 0080379419)
- Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications (ISBN 0-19-855370-6)
- Jon A. McCleverty, N. G. Connelly,Nomenclature of inorganic chemistry II: recommendations 2000, International Union of Pure and Applied Chemistry Commission on the Nomenclature of Inorganic Chemistry, Published by Royal Society of Chemistry, 2001, (ISBN 0-85404-487-6)