Tétrafluorure de thionyle
| Tétrafluorure de thionyle | |
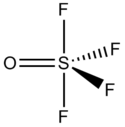
| |
| Structure du tétrafluorure de thionyle | |
| Identification | |
|---|---|
| Nom UICPA | tétrafluoro(oxo)-$l^{6}-sulfane[1],[2] |
| No CAS | |
| PubChem | 139557 |
| SMILES | |
| InChI | |
| Apparence | gaz incolore odorant[3] |
| Propriétés chimiques | |
| Formule | F4OS [Isomères] |
| Masse molaire[4] | 124,058 ± 0,005 g/mol F 61,26 %, O 12,9 %, S 25,85 %, |
| Propriétés physiques | |
| T° fusion | −99,6 °C[3] |
| T° ébullition | −48,5 °C[3] |
| Masse volumique | 1,946 g·cm-3 à −82 °C 2,55 g·cm-3 à −183 °C[3] |
| Précautions | |
| SGH[5] | |
| H280, H314, H330, P260, P264, P271, P280, P284, P301, P303, P304, P305, P310, P330, P331, P338, P340, P351, P353, P361, P363, P403, P405, P410 et P501 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le tétrafluorure de thionyle est un composé chimique de formule SOF4. C'est un gaz incolore à l'odeur très désagréable. Il réagit avec l'eau en une réaction fortement exothermique qui donne du fluorure de thionyle SOF2. Il peut être obtenu en faisant réagit ce dernier composé avec du fluor F2[6], réaction qui peut être catalysée par le fluorure d'argent(I) AgF et le platine : c'est ainsi qu'il fut découvert par Henri Moissan et Paul Lebeau en 1902, qui déterminèrent sa formule chimique par les changements de pression résultant de la réaction.
Il peut également se former en chauffant à 200 °C du fluorure d'argent(II) AgF2 avec du fluorure de thionyle SOF2[7], ou en chauffant à 400 °C de l'hexafluorure de soufre SF6 dans l'air. Une autre façon de le produire consiste à électrolyser du fluorure d'hydrogène HF avec une solution de dioxyde de soufre SO2, ce qui produit également du difluorure d'oxygène OF2 et du fluorure de sulfuryle SO2F2[8].
Le tétrafluorure de thionyle réagit avec l'eau H2O pour produire de l'acide fluorhydrique HF(aq), de l'acide fluorosulfurique HFSO3 et du fluorure de sulfuryle SO2F2. Avec le mercure, il se forme du fluorure de thionyle SOF2 et du fluorure de mercure(I) Hg2F2 :
La réaction avec des bases fortes libère des ions fluorure F− et fluorosulfate SO3F−.
Le tétrafluorure de thionyle peut être utilisé en chimie click à travers des réactions avec des amines primaires consistant en un échange de fluorure de soufre(IV) (appelées « SuFEx » en anglais, pour sulfur(VI) fluoride exchange)[9]. Ce type de réactions fut la première réaction « click » générant une structure tridimensionnelle.
Notes et références modifier
- PubChem CID 139557
- (en) « SULFURYL OXYTETRAFLUORIDE - Alfa Chemistry », sur alfa-chemistry.com via Wikiwix (consulté le ).
- (de) Georg Brauer, Handbuch der Präparativen Anorganischen Chemie. 3e éd., Enke, Stuttgart, 1975, chapitre I, p. 187. (ISBN 3-432-02328-6).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « abcr.de/shop/en/catalog/produc… »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
- (en) Harry Julius Emeléus et A. G. Sharpe, Advances in Inorganic Chemistry and Radiochemistry, vol. 2, Academic Press, 1960, p. 117. (ISBN 9780080578514)
- (en) F. B. Dudley, G. H. Cady et D. F. Eggers Jr., « Pentafluorosulfur Hypofluorite and Thionyl Tetrafluoride », Journal of the American Society, vol. 78, no 8, , p. 1553-1557 (DOI 10.1021/ja01589a013, lire en ligne)
- (en) Nagase Shunji, Abe Takashi et Baba Hajime, « Fluorination of Inorganic Sulfur Compounds », Bulletin of the Chemical Society of Japan, vol. 42, no 7, , p. 2062-2064 (DOI 10.1246/bcsj.42.2062, lire en ligne)
- (en) Suhua Li, Peng Wu, John E. Moses et K. Barry Sharpless, « Multidimensional SuFEx Click Chemistry: Sequential Sulfur(VI) Fluoride Exchange Connections of Diverse Modules Launched From An SOF4 Hub », Angewandte Chemie International Edition, vol. 56, no 11, , p. 2903-2908 (PMID 28165188, DOI 10.1002/anie.201611048, lire en ligne)