Parylène
Le parylène ou polyparaxylylène ou poly (p-xylylène) est un film polymère biocompatible qui se dépose sous vide après évaporation et transformation de son précurseur. Cet article passe en revue la structure du motif du polymère qui constitue le parylène et qui explique comment son procédé de mise en œuvre unique est possible. Les propriétés de conformité et d'uniformité, d'isolation électrique et de barrière chimique, découlant de sa structure et de son procédé de mise en œuvre sont présentées. Ses propriétés optiques et de surface sont aussi exposées ainsi que les différents types de parylène. En effet, en modifiant le motif du polymère de parylène, les propriétés macroscopiques du revêtement s'en trouveront changées.
| Parylène | |
| |
| Identification | |
|---|---|
| Nom UICPA | poly(p-xylylène) |
| Propriétés chimiques | |
| Formule | C8H8 [Isomères] |
| Masse molaire[1] | 104,149 1 ± 0,007 g/mol C 92,26 %, H 7,74 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Introduction
modifierLe film polymère de poly (p-xylylène), communément appelé parylène, a été découvert en 1948 par Szwarc ; la simplification de son processus de dépôt est due à Gorham en 1966. De nouveaux développements dans sa structure chimique ont ensuite été proposés. La principale originalité de ce revêtement réside dans son procédé de mise en œuvre, puisque obtenu à partir de la condensation de monomères gazeux sur les surfaces. Ce procédé assimilable à de la CVD (Chemical Vapor Deposition) confère à ce revêtement des propriétés utiles en termes de conformabilité et d’uniformité. De plus, comme le dépôt s’effectue à température ambiante en l'absence de solvant, il n'y a pas de contraintes résiduelles dans le film [Dabral, 1992]. Ce film transparent, semi cristallin, d’une épaisseur de quelques dizaines de nanomètres ou pouvant dépasser les 100 μm, présente une grande stabilité thermodynamique, une excellente résistance aux solvants [Spivack, 1969] ainsi qu’une très faible perméabilité [Yeh, 1989]. Ces propriétés le rendent particulièrement intéressant en tant que couche protectrice d’éléments sensibles à leur environnement d’utilisation, comme par exemple des capteurs ou implants médicaux [Schmidt, 1988]. Enfin, ses propriétés diélectriques en font un matériau de prédilection dans des applications d’isolation électrique de tout ordre [Juneja, 2006]. Ainsi, le parylène sert diverses industries telles que l’électronique, le médical, la micromécanique, le militaire, les ferrites, aimants ou tous autres matériaux à tendance pulvérulente, les silicones et élastomères, les micro et nanotechnologies, etc.
Structure du parylène
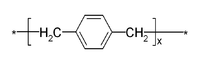
modifierLe p-xylylène ou p-quinodiméthane, constitue le motif de base du parylène. Sa structure à huit atomes de carbone est plane [Beach, 1988]. La mécanique quantique a montré que son état fondamental se présentait sous une forme quinoïde alors que son premier état excité sous une forme aromatique diradicale. La différence d'énergie est de 50 kJ/mol [Coulson, 1947]. La molécule sous sa forme quinoïde est diamagnétique (tous les électrons de valence sont couplés) alors que sa forme aromatique est paramagnétique.
Si l’énergie de résonance du système est source de stabilité du p-xylylène (159 kJ/mol) [Gazicki-Lipman, 2007], la grande densité électronique au voisinage des deux groupes méthyle générée par leur position en "para" implique une haute réactivité permettant la polymérisation spontanée à température ambiante.
Principe de dépôt et polymérisation
modifierLe dépôt du parylène, connu sous le nom le procédé de Gorham [Gorham, 1966], utilise le tricyclo[8.2.2.24, 7]hexadeca-4,6,10,12,13,15-hexaène ou [2,2]paracyclophane, comme précurseur. Le paracyclophane se présente sous une forme solide pulvérulente.
Ce principe de dépôt se décompose en trois étapes.
Sous vide primaire (~10−1 Pa) :
1. Le paracyclophane solide est chauffé à >100 °C pour se sublimer.
2. Les vapeurs de paracyclophane transitent par une zone de pyrolyse à >500 °C permettant la rupture des deux liaisons C–C aliphatiques et la formation de deux molécules de p-xylylène réactive.
3. Pénétrant dans la chambre de dépôt à température ambiante, les molécules de p-xylylène s’adsorbent sur les surfaces et polymérisent spontanément formant le film de parylène.
Une trappe froide est placée à la suite de la chambre de dépôt afin de protéger l'équipement de pompage en capturant tout résidu volatil.
L’épaisseur du film déposée dépend de la surface totale revêtue ainsi que de la quantité de paracyclophane sublimée.
Le mécanisme de polymérisation spontanée du parylène a été beaucoup étudié et les principales voies considérées sont résumées [Utley, 2002].
Expérimentalement on détermine que le taux de dépôt dépend de la température et de la pression de gaz de p-xylylène dans la chambre ; une augmentation de la pression augmente le taux de dépôt proportionnellement, alors qu'une augmentation de la température le diminue. Il y a cependant une pression maximale à ne pas dépasser, sans quoi la formation des chaînes de poly-p-xylylène commence partiellement avant la condensation altérant la qualité finale du film et une pression seuil minimale pour qu'un trimère se forme, amorçant ainsi la polymérisation. Plusieurs modèles de cinétique de dépôt du parylène en fonction de la pression de gaz de p-xylylène dans la chambre et de la température du substrat à revêtir ont été développés. Les plus anciens se fondent sur la cinétique de la réaction chimique d'un monomère s'ajoutant à la chaîne et postulent que la concentration de monomère de p-xylylène sur la surface contrôle la croissance du film. Ils peuvent être séparés en trois catégories suivant le modèle utilisé ; Flory, Langmuir ou Brunauer-Emmett-Teller. Une nouvelle approche considère que le taux d'adsorption d'un monomère sur la surface est le facteur limitant et inclut les phénomènes de physisorption et chimisorption dans un potentiel de Lennard-Jones. Ce modèle dit de la « Chemisorption » offre la meilleure correspondance avec les données expérimentales [Fortin, 2002].
Le taux de dépôt des différents types de parylène dépend de plusieurs facteurs tels le poids moléculaire du monomère gazeux, l’encombrement stérique, ou surtout la réactivité des monomères gazeux. En effet, leur réactivité va se trouver très largement affectée par la présence d’éléments de substitution. Leur position sur le cycle aromatique, ou sur les deux carbones aliphatiques, modifie la polarité de la molécule et donc son niveau d’interaction avec le substrat ou la couche en croissance.
L'adhérence du film parylène sur la surface des substrats à revêtir est essentielle pour garantir toutes les propriétés du film. La préparation de surface est donc très importante. L’inertie chimique du parylène ne conduit bien souvent qu'à des interactions faibles, de type Van der Walls avec le substrat. Un plasma ou un agent de couplage, de type silane, peuvent être appliqués dans une phase de prétraitement. Les silanes permettent de créer un pont entre un substrat inorganique et le film via des liaisons covalentes plus fortes. Il existe deux types de techniques de dépôt qui dépendent du type de pièces à revêtir ; une technique statique pour les pièces fragiles ou de grandes dimensions (~cm) et une technique en brassage constant où les pièces sont en vrac.
Propriétés du revêtement parylène
modifierConsécutivement à ce procédé de dépôt, le film parylène obtenu présente une uniformité d’épaisseur sur toutes les zones affleurant et suit parfaitement la surface du substrat quelle que soit sa complexité morphologique. La grande mobilité du p-xylylène en phase gazeuse assure un pouvoir de pénétration important au film même à l'intérieur d’une porosité ou d'un orifice non débouchant. En éliminant toute intervention (solvant, additif, …) ou réaction de composés parallèles, la fiabilité et la reproductibilité de toute l’opération de revêtement n’est sous la dépendance que des paramètres physiques du procédé et du niveau de pureté du précurseur. Grâce à une mise en œuvre à température ambiante, la couche ainsi formée dépourvue de stress internes, ne sera soumise à un quelconque retrait. Cette procédure rend également le procédé très écologique puisque le processus chimique se déroule en vase clos tandis que les rejets minimes se présentent sous forme solide facilement traitables sur la trappe froide.
La planéité du p-xylylène et la délocalisation des électrons sur le cycle aromatique laissent penser que la croissance des chaînes de polymère est parallèle à la surface du substrat bien qu'il ne semble pas exister de démonstration univoque. Des mesures ont cependant parfaitement illustré que le film est continu (pinhole free) dès 50 nm sur une surface plane et dès 0,5 μm sur tout type de pièce [Beach, 1988].
Les cycles aromatiques du parylène lui confèrent une importante stabilité thermodynamique et par suite des propriétés de barrière imperméable aux solvants et aux gaz. Cette inertie chimique le rend notamment biocompatible et biostable. Le film de parylène est semi cristallin et son taux de cristallinité est très variable. Il va dépendre des conditions de dépôt et du type de parylène. Il peut être modifié via un post-traitement thermique augmentant sa stabilité thermodynamique et ses propriétés de barrière, la phase cristalline étant plus compacte que la phase amorphe et les interactions entre les chaînes plus grandes.
Compte tenu de la faible polarisabilité du motif monomère constitutif du parylène, la constante diélectrique du film est basse (low-k). C'est donc un film isolant pouvant par exemple, avec une épaisseur de 10 μm, résister à 4 000 V.
Concernant ses propriétés de surface, le film présente un bas coefficient de friction, de l'ordre de 0.2 à 0.3 ainsi qu’un caractère hydrophobe avec un angle de mouillabilité de 85 à 90 °.
L'indice de réfraction du film se situe entre 1.6 et 1.7 selon le type de parylène. Dans le spectre visible, le parylène ne présente que quelques absorptions marginales, le film est donc transparent. Dans l'ultraviolet, le parylène présente une forte absorption en dessous de 280 nm de longueur d'onde. Entre 3 000 et 50 000 nm, la transmission du rayonnement est variable, au-delà seules quelques singularités subsistent.
Il a été expérimenté que les propriétés du film restent inchangées après une exposition à une haute dose de rayons gamma (1 MSv) sous vide. A contrario, en présence d’oxygène, si le parylène est soumis à un rayonnement ultraviolet [Fortin, 2001] ou chauffé au-delà de 200 °C durant de longues périodes, il est sujet à se dégrader. En effet, les hydrogènes aliphatiques, présentant une certaine labilité qui est accentuée par la présence immédiate du cycle aromatique, vont pouvoir être substitués. Cette substitution déstabilise la liaison aliphatique C–C et entraîne finalement une scission de la chaîne polymérique. Il s’agit d’une oxydation du polymère aboutissant à la formation de groupements carbonyles et carboxyles sur les cycles aromatiques.
Le revêtement parylène possède de nombreuses certifications notamment dans le domaine médical, électronique militaire et spatial.
Différents types de parylène
modifierLa substitution des hydrogènes aromatiques par des éléments ou des groupements modifie les propriétés du film. Les premiers essais de substitution ont été effectués avec les halogènes (chlore et brome) puis avec les groupes éthyles, méthyles, acétyle ou encore cyano. Seuls les parylènes chlorés ont trouvé une application industrielle. Il existe 3 types disponibles de parylène, N, C et D. Par rapport au parylène N non substitué, le parylène C présente une plus faible perméabilité aux gaz, une meilleure résistance aux acides, une meilleure isolation électrique en basses épaisseurs (< 5 μm), un film avec une meilleure résistance mécanique et à l'usure, et un meilleur rendement de dépôt. Le parylène D résiste lui mieux en température et présente une meilleure barrière à certains gaz et solvants.
Pour des applications biologiques, des recherches ont conduit à des substitutions utilisant les groupes amine, aminométhyle, hydroxyméthyle, hydroxyle ou formyle, pour par exemple, favoriser les interactions entre le film et les acides aminés constitutifs des protéines.
Références
modifier- Szwarc M., 1948 The C-H Bond in Toluene and Xylenes, J. Chem. Phys. Vol. 16 Num. 2, p. 128-136.
- Gorham W. F., 1966 A New, General Synthetic Method for the Preparation of Linear Poly (p-xylylene), J. Polym. Sci. Part A-1 Vol.4, p. 3027-3039.
- Dabral S., Van Etten J., Zhang X., Apblett C., Yang G.-R., Ficalora P. et McDonald J. F., 1992 Stress in Thermally Annealed Parylene Films, J. Electron. Mater. Vol. 21 Num. 10, p. 989-994.
- Spivack M. A. et Ferrante G., 1969 Détermination of the Water Vapor Permeability and Continuity of Ultrathin Parylene Membranes, Electrochem. Soc. Vol. 116 Num. 11, p. 1592-1594.
- Yeh Y.-S., James W. J. et Yasuda H., 1989 Polymerization of para-xylylene derivatives. VI. morphology of parylene N and parylene C films investigated by gas transport characteristics, J. Polym. Sci., Part B: Polym. Phys. Vol. 28 Num. 4, p. 545-568.
- Schmidt E. M., Mcintosh J. S. et Bak M. J., 1988 Long-term implants of Parylene-C coated microelectrodes, Med. Biol. Eng. Comput. Vol. 26 Num. 1, p. 96-101.
- Juneja J. S., Wang P.-I., Karabacak T. et Lu T.-M, 2006 Dielectric barriers, pore sealing, and metallization, Thin Solid Films Vol. 504 Num. 1-2, p. 239-242.
- Beach W. F., 1988 Xylylene Polymers, Encyclopedia of Polymer Science and Technology Vol. 12, p. 587-626.
- Coulson C. A., Craig D. P, Maccoll A. et Pullman A., 1947 P-Quinodimethane and its Diradical, Disc. Faraday Soc. Vol. 2, p. 36.
- Gazicki-Lipman M., 2007 Vapor Deposition Polymerization of para-Xylylene Derivatives - Mechanism and Applications, J. of the Vacuum Soc. of Japan Vol. 50 Num. 10, p. 601-608.
- Utley J. H. P. et Gruber J., 2002 Electrochemical synthesis of poly(p-xylylenes) (PPXs) and poly(p-phenylenevinylenes) (PPVs) and the study of xylylene (quinodimethane) intermediates; an underrated approach, J. Mater. Chem. Vol. 12, p. 1613-1624.
- Fortin J. B. et Lu T.-M., 2002 A Model for the Chemical Vapor Deposition of Poly(para-xylylene) (Parylene) Thin Films, Chem. Mater. Vol. 14 Num. 5, p. 1945-1949.
- Fortin J. B. et Lu T.-M., 2001 Ultraviolet radiation induced degradation of poly (para xylylene) (parylene) thin films, Thin Solid Films Vol. 397, p. 223-228.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
Liens externes
modifier- (fr) Propriétés techniques
- (en) Technical properties
- (de) Tachnische Eigenschaften
Bibliographie
modifier- Mokni M (2016) Optimisation et analyses des propriétés physico-chimiques et diélectriques du parylène D (Doctoral dissertation, Université Grenoble Alpes).
