Indoxyle
L'indoxyle est un composé chimique de formule brute C8H7NO. C'est un dérivé de l'indole, précurseur naturel ou synthétique de l'indigotine, la molécule principale de la teinture d'indigo.
| Indoxyle | |
| |
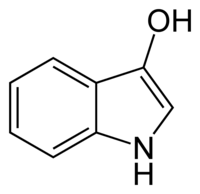
| forme énol de l'indoxyle ultraminoritaire | |
| Identification | |
|---|---|
| Nom UICPA | 1,2-dihydro-3H-indol-3-one 1H-indol-3-ol (forme énol) |
| No CAS | |
| No ECHA | 100.216.308 |
| PubChem | 50591 |
| SMILES | |
| InChI | |
| Apparence | cristaux de couleur jaune clair[1] |
| Propriétés chimiques | |
| Formule | C8H7NO [Isomères] |
| Masse molaire[2] | 133,147 3 ± 0,007 4 g/mol C 72,17 %, H 5,3 %, N 10,52 %, O 12,02 %, |
| Propriétés physiques | |
| T° fusion | 85 °C[1] |
| Solubilité | Soluble dans l'eau, les alcalis, l'éthanol et l'éther[1] |
| Composés apparentés | |
| Isomère(s) | oxindole |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Propriétés modifier
L'indoxyle est une cétone et comme telle il présente un équilibre céto-énolique entre deux formes :
cétone (à gauche) et énol (à droite)
Des analyses spectroscopiques montrent qu'en fait, comme pour la plupart des cétones, la forme cétone est quasiment la seule existante[3].
Synthèse modifier
« Naturelle » modifier
L'indoxyle peut être synthétisée à partir d'une substance naturelle, l'indican, un hétéroside extrait de l'indigotier. Ce dernier est composé d'un cycle de β-D-glucose et d'un cycle d'indoxyle. Une simple hydrolyse suffit à séparer les deux composés.
Industrielle modifier
Les groupes BASF et Hoechst AG ont développé une synthèse industrielle de l'indoxyle à partir de l'acide anthranilique, appelée synthèse de Heumann-Pfleger.
(2) L'acide phénylglycin-o-carboxylique est mis à réagir avec de la soude, formant l'acide 2-indoxycarboxylique.
(3) Ce dernier se décarboxyle en indoxyle.
Notes et références modifier
- Thieme Chemistry (Hrsg.): Römpp Online. Version 3.1. Georg Thieme Verlag, Stuttgart 2007.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Wittko Francke und Wolfgang Walter: Lehrbuch der Organischen Chemie. S. Hirzel Verlag Stuttgart; 24. überarb Auflage 2004, (ISBN 3-7776-1221-9); S. 776
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Indoxyl » (voir la liste des auteurs).