Effet Bohr
L'effet Bohr est la diminution de l'affinité de l'hémoglobine pour l'oxygène (O2) lors d'une augmentation de la pression partielle en dioxyde de carbone (CO2) ou d'une diminution de pH[1],[2].
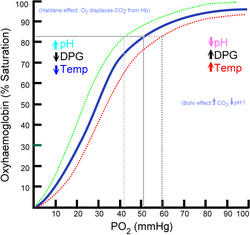
Expérimentalement, cela se traduit, tous les autres paramètres étant fixés, par un décalage vers la droite de la courbe de saturation de l'hémoglobine. Il s'agit d'un effet allostérique. Cet effet fut identifié en 1904 par le physiologiste danois Christian Bohr, père du physicien Niels Bohr.
Modèle moléculaire
modifierLa liaison de CO2 à un acide aminé de l'hémoglobine (Hb) entraîne une modification de sa conformation tridimensionnelle et une diminution de l'affinité pour O2. De plus, la conformation de l'hémoglobine dépend du pH, comme pour toutes les protéines.
CO2 + H2O HCO3− + H+ et HbO2 + H+ HbH+ + O2
Le CO2 a une affinité plus grande pour l'Hb réduite. Il va donc se lier plus facilement à l'Hb, et ce au niveau d'un groupement amine selon
Hb-NH2 + CO2 Hb-NH-COOH
L'effet Bohr a aussi comme facteur le 2-3-BPG (produit de la glycolyse) qui va se fixer à la chaîne bêta de l'hémoglobine entraînant ainsi une meilleure dissociation de Hb-O2. Ce phénomène étant diminué en cas d'acidose par inhibition de la glycolyse est surtout intéressant dans les hautes altitudes où la pression atmosphérique en oxygène est diminuée.
Intérêt physiologique
modifierLa pression partielle en dioxyde de carbone est élevée au niveau des tissus. L'effet Bohr implique alors une libération optimale du dioxygène (O2) transporté par l'hémoglobine, dans les muscles lors des efforts physiques notamment.
L'augmentation de température du milieu et l'augmentation de la concentration en 2,3-diphosphoglycérate diminuent également l'affinité de l'hémoglobine pour O2, favorisant son relargage.
Notes et références
modifier- « Dictionnaire de l'Académie de Médecine », (consulté le )
- les deux étant liées puisque le dioxyde de carbone dissout en milieu aqueux est un acide faible
Voir aussi
modifierArticle connexe
modifier
