Dendrimère
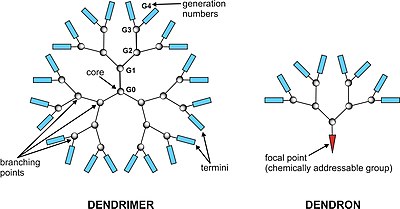
Un dendrimère[1],[2] est une molécule dont la forme reprend celle des branches d'un arbre. Le nom vient du grec δενδρον/dendron, signifiant « arbre. » En 1979, le premier dendrimère a été synthétisé par D.A. Tomalia[3] et d'autres chercheurs de la Dow Chemical Company, et des dendrimères ont depuis été étudiés partout dans le monde pour leur forme unique.
Synthèse modifier
Dans la synthèse des dendrimères, les monomères mènent à un polymère monodispersé, tel un arbre[4]. Il y a deux méthodes définies de synthèse des dendrimères : synthèse divergente[5],[6] et synthèse convergente[7]. La première assemble la molécule du noyau jusqu'à la périphérie et le second de l'extérieur vers le noyau.
Cependant, parce qu'une réaction répétée composée de beaucoup d'étapes est nécessaire pour protéger l'emplacement actif, il est difficile de synthétiser des dendrimères même si les deux méthodes sont employées. C'est pourquoi il y a des obstacles à la synthèse de grandes quantités de dendrimères, toutefois de nombreux progrès ont été accomplis. Suivant les travaux de Sharpless, les méthodes click ont récemment permis un nouvel essor vers des voies de synthèse plus aisées et particulièrement efficaces, notamment avec des étapes de purifications simples permettant d'envisager un avenir industriel[8],[9]. Plus récemment, Nierengarten et Martin ont développé des macromonomères portant dix résidus périphériques qui ont été greffés sur un cœur fullerène à douze branches permettant ainsi d’obtenir des méga-molécules possédant 120 groupements périphériques[10],[11],[12]. Ce mode de construction représente la croissance dendritique la plus rapide jamais décrite. Les méthodes click comprennent tout d'abord la réaction historique CuAAC[13] (consistant en une cycloaddition de Huisgen catalysée par du Cu(I)), mais aussi celles de Diels-Alder (DA)[14] ou le couplage thiol-ène (en) (TEC)[15]. Récemment, quelques séquences employant ces trois différentes méthodes afin d'obtenir aisément des macromolécules fonctionnalisées ont vu le jour, notamment par synthèse one-pot[16].
Propriétés et applications modifier
Les propriétés des dendrimères sont engendrées par les structures moléculaires présentes sur sa surface. Par exemple, un dendrimère peut être hydrosoluble quand son extrémité-groupe est un groupe hydrophile, comme un groupe carboxylique. Il est théoriquement possible de concevoir un dendrimère hydrosoluble avec l'hydrophobicité interne, qui lui permettrait de porter un composé hydrophobe dans son intérieur (afin de transporter un composé thérapeutique hydrophobe dans le sang par exemple).
Une autre propriété est que le volume d'un dendrimère augmente quand il a une charge positive. Si cette propriété peut être appliquée, des dendrimères peuvent être employés pour les systèmes de transport d'éléments chimiques qui peuvent donner le médicament à la partie visée à l'intérieur du corps d'un patient directement (tumeur par exemple).
Les applications sont très diverses, comme un élément organique électroluminescent, comme substitut sanguin, anticancéreux, outils pour la multiplication de cellules, mais aussi en matériaux lors d'associations avec des nanotubes ou comme sondes sélectives et efficaces.
Dendritech[17] vend actuellement un certain nombre de dendrimères de type PAMAM, ainsi que Polymer Factory[18] de type bis-MPA.
Une revue complète sur les fonctions et applications des dendrimères a été publiée en 2010 à Chemical Reviews[2].
Voir aussi modifier
- Dendrimers (2,2-bis (methylol) Propionic Acid)
- (en) « Cambridge display technology (anglophone) »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
Références modifier
- J. M. J. Fréchet, D. A. Tomalia, Dendrimers and Other Dendritic Polymers, John Wiley & Sons, NY, NY, 2001.
- (en) D. Astruc, E. Boisselier, C. Ornelas, « Dendrimers Designed for Functions: From Physical, Photophysical, and Supramolecular Properties to Applications in Sensing, Catalysis, Molecular Electronics, and Nanomedicine », Chem. Rev., vol. 110, , p. 1857-1959 (DOI 10.1021/cr900327d).
- (en) D. A. Tomalia, H. Baker, J. Dewald, M. Hall, G. Kallos, S. Martin, J. Roeck, J. Ryder, P. Smith, « A New Class of Polymers: Starburst-Dendritic Macromolecules », Polymer, vol. 17, , p. 117 (DOI 10.1295/polymj.17.117).
- Groupe Nanosciences Moléculaires et Catalyse.
- (en) Egon Buhleier, Winfried Wehner et Fritz Vögtle, « Cascade- and Nonskid-Chain-like Syntheses of Molecular Cavity Topologies », Synthesis, , p. 155–158 (DOI 10.1055/s-1978-24702).
- Frank Morgenroth, Erik Reuther et Klaus Müllen, Polyphenylene Dendrimers: From Three-Dimensional to Two-Dimensional Structures, Angewandte Chemie International Edition in English, vol. 36, no 6, 4 avril 1997, p. 631-634, DOI 10.1002/anie.199706311.
- (en) C. J. Hawker et J. M. J. Fréchet, « Preparation of polymers with controlled molecular architecture. A new convergent approach to dendritic macromolecules », J. Am. Chem. Soc., vol. 112, , p. 7638 (DOI 10.1021/ja00177a027).
- P. Antoni, Y. Hed, A. Nordberg, D. Nyström, H. von Holst, A. Hult et M. Malkoch, Bifunctional Dendrimers: From Robust Synthesis and Accelerated One-Pot Postfunctionalization Strategy to Potential Applications, Angew. Int. Ed., 2009, 48 (12), p. 2126-2130, DOI 10.1002/anie.200804987.
- (en) G. Franc, A. K. Kakkar, « Click Methodologies: Efficient, Simple and Greener Routes to Design Dendrimers », Chemical Society Reviews, (DOI 10.1039/b913281n).
- (en) A. Muñoz, D. Sigwalt, B. M. Illescas, J. Luczkowiak, L. Rodríguez, I. Nierengarten, M. Holler, J.-S. Remy, K. Buffet, S. P. Vincent, J. Rojo, R. Delgado, J.-F. Nierengarten et N. Martín, Synthesis of giant globular multivalent glycofullerenes as potent inhibitors in a model of Ebola virus infection, vol. 8, Nature Chemistry, (présentation en ligne), p. 50-57.
- « Des molécules géantes antivirales », sur Pour la science, Éditions Belin, .
- « Une molécule géante pour lutter contre Ebola », La Tribune de Genève, .
- (en) G. Franc, A. K. Kakkar, « Dendrimers Design Using CuI-Catalyzed Alkyne–Azide Click Chemistry », Chemical Communications, , p. 5267-5276 (DOI 10.1039/b809870k).
- (en) G. Franc et A. K. Kakkar, « Diels-Alder Click Chemistry in Designing Dendritic Macromolecules », Chemistry: A European Journal, vol. 15, , p. 5630-5639 (DOI 10.1002/chem.200900252).
- (en) K. L. Killops, L. M. Campos et C. J. Hawker, « Robust, Efficient, and Orthogonal Synthesis of Dendrimers via Thiol-Ene Click Chemistry », J. Am. Chem. Soc., vol. 130, , p. 5062-5064 (DOI 10.1021/ja8006325).
- (en) X. Q. Xiong, « Efficient Synthesis of Dendritic Architectures by One-Pot Double Click Reactions », Australian Journal of Chemistry, vol. 62, , p. 1371 (DOI 10.1071/CH09052).
- Dendritech.
- Polymer Factory AB, Stockholm, Sweden Polymer Factory.