Protéine réceptrice de l'AMPc
| Protéine réceptrice de l'AMPc | |
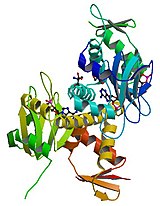
| |
| Structure de la protéine réceptrice de l'AMPc chez E. coli. | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
La protéine récepteur d'AMPc (en anglais CRP ; également appelée protéine activatrice de catabolite PAC ou CAP en anglais) est une protéine régulatrice que l'on trouve chez les bactéries. La protéine CRP se lie à l'AMPc, ce qui provoque un changement de conformation qui permet à la CRP de se lier étroitement à un site d'ADN spécifique au niveau des promoteurs des gènes qu'elle contrôle[1],[2]. La CRP active ensuite la transcription par le biais d'interactions directes de type protéine–protéine avec l'ARN polymérase[1],[2].
Les gènes régulés par la CRP sont principalement impliqués dans le métabolisme énergétique, tel que la dégradation du galactose, du citrate ou encore le système de translocation du groupe PEP[3],[4]. Chez Escherichia coli, la CRP peut réguler la transcription de plus de 100 gènes.
Le signal pour activer la CRP est la liaison avec l'AMP cyclique. La liaison de l'AMPc à la CRP conduit à une transduction de signal à longue distance à partir du domaine de liaison à l'AMPc N-terminal au domaine C-terminal de la protéine. C'est cette partie qui est responsable de l'interaction avec des séquences spécifiques au niveau de l'ADN[5].
Chez les promoteurs dépendants de la CRP dits de "classe I", la CRP se lie à un site de l'ADN situé en amont des promoteurs principaux et active la transcription par le biais d'interactions de type protéine–protéine entre la "région d'activation 1" de la CRP et le domaine C-terminal de la sous-unité alpha de l'ARN polymérase[1],[2],[6]. Chez les promoteurs dépendants de la CRP dits de "classe II", la CRP se lie à un site sur l'ADN qui chevauche l’élément -35 du promoteur et active la transcription par le biais de deux ensembles d’interactions de type protéine–protéine : (1) une interaction entre la "région d'activation 1" de la CRP et le domaine C-terminal de la sous-unité alpha de l'ARN polymérase et (2) une interaction entre la "région d'activation 2" de la CRP et le domaine N-terminal de la sous-unité alpha de l'ARN polymérase[1],[2]. Chez les promoteurs dépendants de la CRP dits de "classe III", la CRP fonctionne conjointement avec une ou plusieurs protéines dites "co-activatrices"[1],[2].
Chez la plupart des promoteurs dont l'activation est dépendante de la CRP, celle-ci active la transcription principalement ou exclusivement par le biais d'un mécanisme de "recrutement", dans lequel des interactions de type protéine–protéine entre la CRP et l'ARN polymérase facilitent la liaison de l'ARN polymérase au promoteur[1].
Voir aussi modifier
Notes modifier
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « CAMP receptor protein » (voir la liste des auteurs).
Références modifier
- Busby S., Ebright RH., « Transcription activation by catabolite activator protein (CAP) », J. Mol. Biol., vol. 293, no 2, , p. 199–213 (PMID 10550204, DOI 10.1006/jmbi.1999.3161)
- « Catabolite activator protein: DNA binding and transcription activation », Curr. Opin. Struct. Biol., vol. 14, no 1, , p. 10–20 (PMID 15102444, PMCID 2765107, DOI 10.1016/j.sbi.2004.01.012)
- « The galactose regulon of Escherichia coli », Mol. Microbiol., vol. 10, no 2, , p. 245–51 (PMID 7934815, DOI 10.1111/j.1365-2958.1993.tb01950.x, lire en ligne)
- Bott M, « Anaerobic citrate metabolism and its regulation in enterobacteria », Arch. Microbiol., vol. 167, nos 2–3, , p. 78–88 (PMID 9133329, DOI 10.1007/s002030050419)
- Popovych, Tzeng, Tonelli et Ebright, « Structural basis for cAMP-mediated allosteric control of the catabolite activator protein », Proceedings of the National Academy of Sciences, vol. 106, no 17, , p. 6927–6932 (PMID 19359484, PMCID 2678429, DOI 10.1073/pnas.0900595106)
- Hudson, Quispe, Lara-Gonzalez et Kim, « Three-dimensional EM structure of an intact activator-dependent transcription initiation complex », Proceedings of the National Academy of Sciences, vol. 106, no 47, , p. 19830–19835 (PMID 19903881, PMCID 2775702, DOI 10.1073/pnas.0908782106)