Urubu noir
Coragyps atratus
| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Classe | Aves |
| Ordre | Accipitriformes |
| Famille | Cathartidae |
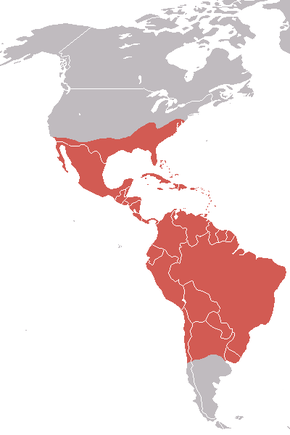
Répartition géographique
L’Urubu noir (Coragyps atratus) aussi appelé Vautour urubu ou vautour noir, est l'une des espèces d'urubus charognards vivant sur le continent américain. Il appartient à la famille des Cathartidae. Son aire de répartition s’étend du sud-est des États-Unis au centre du Chili et à l’Uruguay en Amérique du Sud. Bien qu’il s’agisse d’une espèce commune et disposant d’une vaste aire de répartition, cette dernière reste moins importante que celle de l'Urubu à tête rouge, présent du Canada jusqu’à la Terre de feu. Il s’agit de l’unique représentant encore existant du genre Coragyps, au sein de la famille des Cathartidae. On le trouve dans des habitats relativement ouverts, avec quelques broussailles ou forêts éparses[1]. Avec une envergure de 1,5 m, l’Urubu noir est un grand oiseau, mais un petit vautour. Il a un plumage noir, un cou gris-noir déplumé et un bec crochu.
L’Urubu noir est un charognard qui se nourrit de charognes, mais mange aussi des œufs ou des animaux nouveau-nés qu’il tue lui-même. Dans les régions où l’homme est présent, il se nourrit également de déchets ménagers. Il trouve sa nourriture grâce à son excellente vue ou en suivant d’autres vautours possédant un excellent odorat. Ne possédant pas de syrinx — l’organe vocal des oiseaux — ses seuls cris sont des grognements ou de petits sifflements[2]. Il pond ses œufs dans des grottes, des arbres creux ou sur le sol nu, et élève généralement deux oisillons chaque année, qu’il nourrit par régurgitation. Aux États-Unis, cet urubu est protégé par la Convention concernant les oiseaux migrateurs[3]. Ce vautour apparaît dans les codex mayas.
Description modifier
L’Urubu noir est un grand oiseau de proie, mesurant 56 à 74 cm de long, pour une envergure de 1,33 à 1,67 m[4]. Le poids de l'Urubu noir en Amérique du Nord et dans les Andes varie entre 1,6 et 3 kg, mais les vautours plus petits vivant dans les plaines tropicales pèsent entre 1,18 et 1,94 kg[5],[6]. 50 vautours étudiés au Texas pesaient en moyenne 2,15 kg tandis que des pesées sur 119 oiseaux au Venezuela ont révélé un poids moyen de 1,64 kg[7]. Une fois l'aile déployée, son os mesure entre 38,6 et 45 cm, la courte queue mesure 16 à 21 cm et le tarse de 7 à 8,5 cm[8]. Son plumage est principalement noir brillant d'où son nom vernaculaire en anglais de Black Vulture[9] ou de Vautour noir en Guyane française[10],[11]. La tête et le cou de cet animal sont dépourvus de plumes et la peau est gris foncé[12]. L’iris de l’œil est marron et a une seule rangée incomplète de cils sur la paupière inférieure[13]. Les pattes sont blanc grisâtre[14], tandis que les deux orteils de devant sont longs et ont une petite palmure à leur base[2]. Les pieds sont plats, relativement faibles, et peu adaptés à la préhension. Les talons ne sont pas adaptés non plus pour saisir, et sont relativement émoussés.
Les narines ne sont pas séparées par un septum, mais sont perforées, et on peut voir de part et d’autre du bec à travers elles[15]. Les ailes sont larges mais relativement courtes. Les bases des plumes primaires sont blanches, et forment une marque blanche sur le bord inférieur des ailes, visible lorsque l’animal est en vol. La queue est courte et carrée, dépassant à peine le bord des ailes repliées[12]. Les sous-espèces diffèrent en taille selon la loi de Bergmann, et la quantité de coloration blanche sous les ailes varie également.
Un Coragyps atratus brasiliensis leucistique a été observé à Piñas, en Équateur en 2005. Il avait un plumage entièrement blanc, avec seulement le tarse et la queue ainsi que quelques plumes du dessous de la queue noires. Il n’était pas albinos car sa peau semblait avoir la coloration sombre classique, et il faisait partie d’un groupe de 20 individus normalement colorés[16].
Ecologie et comportement modifier
Lorsqu’il cherche sa nourriture il monte haut dans le ciel, gardant ses ailes horizontales tout en planant. Il bat des ailes rapidement avant de planer sur un court laps de temps[17]. Son vol est moins efficace que celui des autres vautours, car ses ailes sont plus courtes, et constituent une moindre surface pour s’appuyer sur l’air[18]. Par rapport à l'Urubu à tête rouge, l’Urubu noir bat ses ailes plus fréquemment pendant qu’il vole. Il est connu pour régurgiter sa nourriture lorsqu’il est approché par un autre animal ou perturbé, ce qui contribue à dissuader les prédateurs et l’aide à prendre son envole du fait du lest dont il s’est ainsi débarrassé. Comme tous les autres vautours d’Amérique, l’Urubu noir défèque souvent sur ses propres pattes, utilisant ainsi l’évaporation de l’eau contenu dans ses fèces et son urine pour refroidir son corps, un processus appelé urohidrose[2]. Cela permet de refroidir les vaisseaux sanguins de la partie sans plume du tarse et les pattes, et explique les marques blanches laissées sur les pattes par l’acide urique. Du fait de l’absence de syrinx, l’Urubu noir, comme les autres vautours américains, émet très peu de sons[2]. Il est généralement silencieux, mais peut émettre de petits sifflements et grognements. C’est un oiseau grégaire, qui se rassemble en larges groupes[9]. Dans les régions où leurs aires de répartition se chevauchent, l’Urubu noir peut se poser sur des branches d’arbres morts en compagnie de l'Urubu à tête rouge[18]. Il se nourrit généralement en groupes ; un petit groupe d’Urubu noir peut facilement chasser un Urubu à tête rouge, qui se nourrit généralement seul, d’une carcasse[9].
Comme l'Urubu à tête rouge, ce vautour est souvent vu dans une posture caractéristique avec les ailes déployées[12]. Ce comportement semble avoir plusieurs fonctions : sécher les ailes, réchauffer le corps, et que le soleil détruise les bactéries. Le même comportement a été observé chez les autres Cathartidae, les Gypaetinae (en), les Aegypiinae et les cigognes[19].
Distribution et habitat modifier
L’Urubu noir a une distribution néarctique et néotropical[20]. Son aire de répartition comprend le sud des États-Unis, le Mexique, l’Amérique centrale et la majeure partie de l’Amérique du Sud. Il est résident permanent dans la majeure partie de son aire de répartition, bien qu’il arrive que les oiseaux vivant le plus au nord migrent sur de petites distances, et que de petites populations se déplacent en cas de conditions défavorables[21]. En Amérique du Sud, son aire de répartition comprend le centre du Chili et l’Argentine[22]. On le rencontre également sur les îles des Caraïbes[1]. Il préfère les habitats ouverts entrecoupés de petites zones de bois ou de brousse[23]. On peut également le rencontrer dans les forêts humides à basse altitude, dans les zones buissonnantes et dans les prairies, zones humides, marais et pâtures[1]. Préférant les faibles altitudes, on le voit rarement dans les zones montagneuses. On l’observe souvent perché sur des piquets de clôture ou des arbres morts[14].
Alimentation modifier
En conditions naturelles, l’Urubu noir se nourrit principalement de charognes[24]. Dans les zones peuplées par l’Homme, il peut également se nourrir dans les décharges, mais aussi se nourrir d’œufs ou de végétaux en décomposition et peut tuer ou blesser des mammifères nouveau-nés ou ne pouvant pas se défendre. Comme les autres vautours, il joue un rôle important dans l’écosystème en mangeant les charognes qui seraient sans cela des terreaux fertiles au développement de maladies[25]. L’Urubu noir trouve sa nourriture par la vue mais également en suivant des vautours du genre Cathartes jusqu’aux carcasses. Ces vautours — l'Urubu à tête rouge, l'Urubu à tête jaune, et le Grand urubu — localisent leur nourriture grâce à leur odorat, une faculté peu commune chez les oiseaux. Ils volent à basse altitude pour détecter l’odeur du mercaptan éthylique, un gaz produit lors du début de la composition des animaux morts[26] Cette bonne capacité à détecter les odeurs leur permet de trouver des charognes sous la canopée[19]. Le Sarcoramphe roi et l’Urubu noir, qui n’ont pas la faculté de sentir les charognes, les suivent donc jusqu’aux carcasses[25]. Il devient agressif lorsqu’il se nourrit, et peut chasser l'Urubu à tête rouge, légèrement plus gros, des carcasses[24].
L’Urubu noir s’attaque occasionnellement aux troupeaux de bovins et aux cerfs. C’est la seule espèce de vautours d’Amérique à pratiquer de la sorte. Il poursuit les vaches prêtes à mettre bas et s’attaque en priorité aux nouveau-nés. Dans ses premières semaines, le veau ne va pas empêcher les vautours de l’approcher. Les vautours l’entourent en groupe et vont becqueter ses yeux, son nez et sa langue. Le veau peut parfois mourir de ses attaques[27].
L’Urubu noir a parfois été observé en train d'attraper les tiques sur des Capybaras au repos[28].
Prédateurs modifier
L'Urubu noir est peu sujet à la prédation par d'autres espèces. Les œufs et les oisillons peuvent être consommés s'ils sont trouvés par certains mammifères comme les ratons-laveurs, les coatis et les renards. Du fait de son agressivité et de sa taille, très peu de prédateurs peuvent menacer le vautour adulte. Toutefois certains aigles peuvent tuer ces vautours lors de combats, et même l'Aigle orné, un oiseau légèrement plus petit que ce vautour, peut le chasser pour le manger[29].
Reproduction modifier
La période de reproduction de l’Urubu noir dépend de l’altitude à laquelle il vit. Aux États-Unis par exemple, les oiseaux de Floride commencent à se reproduire en janvier, tandis que ceux de l’Ohio ne commencent pas avant mars[30]. En Amérique du Sud, les Urubus noirs d’Argentine et du Chili commencent à pondre leurs œufs en septembre, tandis que ceux de la partie plus septentrionale du continent attendent octobre. Certains animaux se reproduisent même encore plus tard, et les vautours de Trinidad ne commencent pas avant novembre, et ceux d’Équateur peuvent attendre jusqu’en février[30]. Les couples se forment à la suite d'une parade nuptiale qui se déroule au sol : plusieurs mâles entourent une femelle avec leurs ailes partiellement déployées et ils se pavanent et balancent leur tête[12]. Ils peuvent parfois faire des parades en vol, plonger ou se pourchasser[30].
L’Urubu noir pond ses œufs au sol dans une aire boisée, dans un tronc creux ou dans une autre cavité, rarement à plus de 3 m du sol[12] Il n’utilise pas de matériaux pour construire le nid, mais peut décorer les alentours avec des morceaux de plastiques colorés, des morceaux de verre ou des objets en métal comme des capsules de bouteille[23]. La couvée comporte généralement deux œufs, bien que ce nombre peut varier de 1 à 3. L’œuf est ovale et mesure en moyenne 7.56 à 5,09 cm. La coquille est lisse, de couleur gris vert, bleuâtre ou blanche et présente des petits points brun pâle vers du côté le plus gros[23]. Les deux parents couvent les œufs, qui éclosent au bout de 28 à 41 jours[23]. Les jeunes juste éclos sont couverts d’un duvet blanc[24]. Les deux parents participent à nourrir les jeunes par régurgitation. Les petits restent dans le nid durant deux mois, et après 75 à 80 jours ils sont capables de voler correctement[18].
Taxinomie modifier
Le nom spécifique de cette espèce, atratus, signifie « vêtu de noir »[31], du latin ater signifiant « noir »[32]. Le nom de genre, Coragyps, signifie « vautour-corbeau »[33], par contraction des mots grecs corax/κόραξ et gyps/γὺψ désignant respectivement ces deux oiseaux. Le nom de la famille, Cathartidae, signifie « épurateur » et vient du grec kathartēs/καθαρτης[33],[34].
Le classement taxinomique exact de l’Urubu noir et des 6 autres espèces de Cathartidae reste mal connu[35]. Bien que similaires en apparence, et occupant la même niche écologique, les Cathartidae, les Gypaetinae et les Aegypiinae ont évolué à partir d’ancêtres différents dans des zones géographiques bien distinctes. C’est pour savoir à quel point ces deux familles sont différentes que les scientifiques débattent, certains d’entre eux ayant suggéré que les Cathartidae étaient plus apparentés aux cigognes[36]. Des études plus récentes ont maintenu leur place au sein de l’ordre des Falconiformes avec les Old World vultures[37], ou les ont placés dans un ordre à part, les Cathartiformes[38]. Le South American Classification Committee a retiré les Cathartidae des Ciconiiformes pour les placer comme Incertae sedis, tout en notant qu’il était envisageable de les classer avec les Falconiformes ou les Cathartiformes[35].
Il y a trois sous-espèces d’Urubu noir :
- C. a. atratus, nommé par l’ornithologue allemant Johann Matthäus Bechstein en 1793, est la sous-espèce nominale. Il fait approximativement la même taille que C. a. foetens, mais son plumage n’est pas aussi sombre. Son aire de répartition s’étend du nord du Mexique au New Jersey et la Pennsylvanie en passant par le Texas[39].
- C. a. brasiliensis, nommé par Charles-Lucien Jules Laurent Bonaparte en 1850, est plus petit que C. a. atratus et C. a. foetens. Les marques claires sur la partie inférieure des plumes primaires sont plus blanches et plus larges que chez les autres sous-espèces, et le dessous des ailes est plus clair que chez C. a. foetens[40]. On le rencontre en Amérique Centrale et en Amérique du Sud. Au sud, son aire de répartition s’étend jusqu’au régions côtières du Pérou à l’ouest et aux plaines de Bolivie à l’est. Au nord, on le trouve jusqu’à Sonora à l’ouest du Mexique et à San Luis Potosí dans l’est du pays. Il est absent des zones d’altitude[40].
- C. a. foetens, nommé par Martin Lichtenstein en 1817, fait approximativement la même taille que C. a. atratus[40]. Les marques sur la partie inférieure des plumes primaires sont plus petites que chez la sous-espèce nominale, et le dessous des ailes est plus sombre. On trouve cette sous-espèce dans les Andes, au nord de l’Équateur, au Pérou, au nord de la Bolivie, au Paraguay, en Uruguay, et dans les plaines du Chili[40].
Histoire évolutive de Coragyps modifier
Du Pléistocène inférieur au Pléistocène supérieur, une espèce préhistorique d’Urubu noir, Coragyps occidentalis, vivait à travers l’aire de répartition de l’espèce actuelle. Cet oiseau ne différait pas beaucoup de l’espèce actuelle, à l’exception de sa taille ; il était 10 à 15 % plus grand et avait un bec plus large et relativement plus aplati[41]. Il occupait par ailleurs la même niche écologique que l’espèce actuelle[42], et semble en être l’ancêtre direct après avoir réduit de taille au cours de la dernière ère glaciaire[43],[44]. Bien étudié grâce à la découverte de nombreux fossiles, le genre Coragyps donne un aperçu rare de la dynamique d’évolution de deux chrono-espèces. L’Homme a vraisemblablement été témoin de la dernière étape de cette évolution : un os subfossile de l’espèce éteinte, datant des paléoaméricains ou de la période archaïque des Amériques (9000–8000 ans BCE), a été retrouvé dans les amas coquillier des chutes de Celilo près de The Dalles[45].
On ne peut pas déterminer si des Urubus noirs fossiles appartiennent à l’espèce du Pléistocène ou à l’espèce actuelle sans informations supplémentaires : en effet on retrouve la même variation de taille entre les individus au sein de chaque espèce. En 1968, Hildegarde Howard sépare les oiseaux mexicains dans la sous-espèce Coragyps occidentalis mexicanus, les opposant aux oiseaux vivant plus au nord (comme à Rancho La Brea) qui constitue la sous-espèce nominale C. o. occidentalis[46]. Les oiseaux du sud étaient de la même taille que les oiseaux de la sous-espèce C. a. atratus actuels, et on peut les en distinguer uniquement par leur tarsometatarsus quelque peu plus robuste et leur bec plus large, la localisation géographique des fossiles étant le seul critère qui apporte un degré de certitude satisfaisant[47]. Comme l’espèce du Pléistocène et l’Urubu noir actuel forment un continuum en termes d’évolution plutôt qu’un exemple de radiation évolutive en plusieurs lignées, certains incluent le taxon du Pléistocène au sein de C. atratus[44].
Notes et références modifier
- (en) « Coragyps atratus » [archive], sur iucnredlist.org (consulté le )
- (en) J. Alan Feduccia, The Origin and Evolution of Birds, Chicago/London, Yale University Press, , 116 p. (ISBN 0-226-05641-4, lire en ligne)
- (en) « Birds Protected by the Migratory Bird Treaty Act » [archive], sur fws.org (consulté le )
- (en) « Nature Guides » [archive du ], Enature.com (consulté le )
- Black Vulture, Life History, All About Birds – Cornell Lab of Ornithology. allaboutbirds.org
- Ferguson-Lees, James et Christie, David A., Raptors of the World, Houghton Mifflin Harcourt, (ISBN 978-0-618-12762-7, lire en ligne), p. 309
- CRC Handbook of Avian Body Masses, 2nd Edition by John B. Dunning Jr. (Editor). CRC Press (2008), (ISBN 978-1-4200-6444-5).
- Raptors of the World by Ferguson-Lees, Christie, Franklin, Mead & Burton. Houghton Mifflin (2001), (ISBN 0-618-12762-3)
- « All About Birds: Black Vulture », Cornell Lab of Ornithology, (consulté le )
- Pierre A. Reynaud, Véronique Defrance et Delorme, Histoire de plume : l'homme et l'oiseau en Guyane, ORSTOM, , 161 p. (ISBN 9782908693041), p. 66
- Pierre Grenand, Introduction à l'étude de l'univers Wayãpi : ethnoécologie des Indiens du Haut-Oyapock, Guyane française, SELAF, , 332 p. (ISBN 9782852970861), p. 154
- (en) J. K. Terres, The Audubon Society Encyclopedia of North American Birds, New York, NY, Knopf, , 959 p. (ISBN 0-394-46651-9)
- (en) Harvey L. Fisher, « The Pterylosis of the Andean Condor », Condor, vol. 44, no 1, , p. 30–32 (DOI 10.2307/1364195, lire en ligne)
- Roger Tory Peterson, A Field Guide to Western Birds, Houghton Mifflin Field Guides, , 182 p. (ISBN 0-618-13218-X, lire en ligne)
- (en) Michael Allaby, The Concise Oxford Dictionary of Zoology, Oxford, UK, Oxford University Press, , 348 p. (ISBN 0-19-286093-3)
- (en) Peter A Hosner, « Observations of plumage pigment aberrations of birds in Ecuador, including Ramphastidae », Boletín de la Sociedad Antioqueña de Ornitología, vol. 16, no 1, , p. 30–42 (lire en ligne [PDF], consulté le )
- C S. Robbins, B Bruun et H S Zim, Birds of North America : A Guide to Field Identification, St. Martin's Press, , 66 p. (ISBN 1-58238-090-2, lire en ligne)
- Charles Fergus, Wildlife of Virginia and Maryland Washington D.C., Stackpole Books, , 172 p. (ISBN 0-8117-2821-8, lire en ligne)
- Noel F. R. Snyder et Helen Snyder, Raptors of North America : Natural History and Conservation, Voyageur Press, , 45 p. (ISBN 0-7603-2582-0, lire en ligne)
- John L Bull, Levine, Emanuel, Bull's Birds of New York State, Cornell University Press, , 138 p. (ISBN 0-8014-3404-1, lire en ligne)
- Buckley, N. J. (1999). Black Vulture (Coragyps atratus). In The Birds of North America, No. 411 (A. Poole and F. Gill, eds.). The Birds of North America, Inc., Philadelphia, PA.
- Stephen L. Hilty, A Guide to the Birds of Colombia, Princeton University Press, , 88 p. (ISBN 0-691-08372-X, lire en ligne)
- Hal H. Harrison, A Field Guide to Western Birds' Nests, Houghton Mifflin Field, , 33 p. (ISBN 0-618-16437-5, lire en ligne)
- Reader's Digest Editors, Book Of North American Birds, Reader's Digest, , 11 p. (ISBN 0-89577-351-1, lire en ligne)
- LG Gomez, DC Houston, P Cotton et A Tye, « The role of greater yellow-headed vultures Cathartes melambrotus as scavengers in neotropical forest », Ibis, vol. 136, no 2, , p. 193–196 (DOI 10.1111/j.1474-919X.1994.tb01084.x, lire en ligne [archive du ], consulté le )
- (en) Dietland Muller-Schwarze, Chemical Ecology of Vertebrates, Cambridge, Cambridge University Press, , 350 p. (ISBN 0-521-36377-2, lire en ligne)
- Laurie Paulik, « Vultures and Livestock », AgNIC Wildlife Damage Management Web, (consulté le )
- Ivan Sazima, « Unexpected cleaners: black vultures (Coragyps atratus) remove debris, ticks, and peck at sores of capybaras (Hydrochoerus hydrochaeris), with an overview of tick-removing birds in Brazil », Rev. Bras. Ornitol., vol. 15, no 1, , p. 417–426 (lire en ligne)
- Raptors of the World by Ferguson-Lees, Christie, Franklin, Mead & Burton. Houghton Mifflin (2001), (ISBN 0-618-12762-3).
- James Ferguson-Lees et David A. Christie, Raptors of the World, Londres, Christopher Helm, , 306 p. (ISBN 0-7136-8026-1)
- Whitaker, William, « Words by William Whitaker » [archive du ] (consulté le )
- D.P. Simpson, Cassell's Latin Dictionary, Londres, Cassell Ltd., , 5e éd., 883 p. (ISBN 0-304-52257-0)
- Ietaka, Taro, « Moving Beyond Common Names » (consulté le )
- Henry George Liddell et Robert Scott, Greek-English Lexicon, Abridged Edition, Oxford, Oxford University Press, , 804 p. (ISBN 0-19-910207-4)
- Remsen, J. V., Jr.; C. D. Cadena; A. Jaramillo; M. Nores; J. F. Pacheco; M. B. Robbins; T. S. Schulenberg; F. G. Stiles; D. F. Stotz & K. J. Zimmer. 2007. A classification of the bird species of South America. South American Classification Committee. Retrieved on 2007-10-15
- . Sibley, Charles G. et Burt L. Monroe. 1990. Distribution and Taxonomy of the Birds of the World. Yale University Press. (ISBN 0-300-04969-2). Accessed 2007-04-11.
- Sibley, Charles G., and Jon E. Ahlquist. 1991. Phylogeny and Classification of Birds: A Study in Molecular Evolution. Yale University Press. (ISBN 0-300-04085-7). Accessed 2007-04-11.
- Ericson, Per G. P.; Anderson, Cajsa L.; Britton, Tom; Elżanowski, Andrzej; Johansson, Ulf S.; Kallersjö, Mari; Ohlson, Jan I.; Parsons, Thomas J.; Zuccon, Dario & Mayr, Gerald (2006): Diversification of Neoaves: integration of molecular sequence data and fossils. Biology Letters online: 1-5. DOI 10.1098/rsbl.2006.0523 PDF preprint Electronic Supplementary Material (PDF)
- United States Department of Agriculture, Animal and Plant Health Inspection Service, Fact Sheet, MANAGING VULTURE DAMAGE, January 2003, http://www.aphis.usda.gov/ws/statereports/NJ/vulturenj.pdf
- (en) Blake, Emmet Reid, Birds of Mexico : A Guide for Field Identification, Chicago/London, University of Chicago Press, , 267 p. (ISBN 0-226-05641-4, lire en ligne)
- Harvey L Fisher, « The skulls of the Cathartid vultures », Condor, vol. 46, no 6, , p. 272–296 (DOI 10.2307/1364013, lire en ligne [PDF], consulté le )
- Fritz Hertel, « Ecomorphological indicators of feeding behavior in Recent and fossil raptors. », Auk, vol. 12, no 4, , p. 890–903 (lire en ligne [PDF], consulté le )
- (en) Hildegarde Howard, « Bird Remains from a Prehistoric Cave Deposit in Grant County, New Mexico », The Condor, American Ornithological Society, vol. 64, no 3, , p. 241–242 (DOI 10.2307/1365205, lire en ligne [PDF], consulté le )
- David W Steadman, Joaquin Arroyo-Cabrales, Eileen Johnson et A. Fabiola Guzman, « New Information on the Late Pleistocene Birds from San Josecito Cave, Nuevo Leon, Mexico », Condor, vol. 96, no 3, , p. 577–589 (DOI 10.2307/1369460, lire en ligne [PDF], consulté le )
- (en) Loye Miller, « Bird Remains from an Oregon Indian Midden », Condor, vol. 59, no 1, , p. 59–63 (DOI 10.2307/1364617, lire en ligne [PDF], consulté le )
- Hildegarde Howard, « Limb measurements of the extinct vulture, Coragyps occidentalis », Papers of the Archaeological Society of New Mexico, vol. 1, , p. 115–127
- Joaquin Arroyo-Cabrales et Eileen & Guzman Johnson, « Catálogo de los ejemplares tipo procedentes de la Cueva de San Josecito, Nuevo León, México ("Catalogue of the type specimens from San Josecito Cave, Nuevo León, Mexico") », Revista Mexicana de Ciencias Geológicas, vol. 20, no 1, , p. 79–93 (lire en ligne [PDF], consulté le )
Liens externes modifier
- (fr) Référence Oiseaux.net : Coragyps atratus (+ répartition)
- (en) Référence Congrès ornithologique international : Coragyps atratus dans l'ordre Accipitriformes (consulté le )
- (en) Référence Zoonomen Nomenclature Resource (Alan P. Peterson) : Coragyps atratus dans Accipitriformes
- (en) Référence Tree of Life Web Project : Coragyps atratus
- (en) Référence Catalogue of Life : Coragyps atratus (Bechstein, 1793) (consulté le )
- (fr + en) Référence Avibase : Coragyps atratus (+ répartition)
- (en) Référence Paleobiology Database : Coragyps atratus (Bechstein 1793)
- (fr + en) Référence ITIS : Coragyps atratus (Bechstein, 1793)
- (en) Référence UICN : espèce Coragyps atratus (Bechstein, 1793) (consulté le )
- (en) Référence Animal Diversity Web : Coragyps atratus
- (en) Référence NCBI : Coragyps atratus (taxons inclus)