Vallée de stabilité
La vallée de stabilité désigne, en physique nucléaire, l'endroit où se situent les isotopes stables, quand on porte en abscisse le numéro atomique et en ordonnée le nombre de neutrons de chaque isotope (carte des nucléides - les deux axes sont parfois inversés sur certaines représentations).
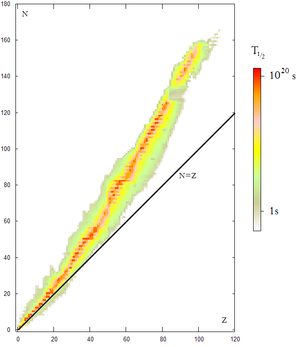
Représentations graphiques modifier
Certains isotopes sont stables, d'autres ne le sont pas et donnent, après une émission radioactive, naissance à un autre élément qui peut être lui-même sous la forme d'un isotope stable ou radioactif. Lorsqu'on reporte sur un repère graphique, repère dont l'axe des ordonnées représente le nombre de protons (Z) et l'axe des abscisses le nombre de neutrons (N) de tous les isotopes connus, on constate que tous les isotopes stables sont regroupés autour d'une courbe nommée vallée de stabilité. On peut représenter de même en chaque point l'énergie de liaison par nucléons, le relief ainsi obtenu dessine alors une péninsule (les zones stables où l'énergie de liaison est positive), prolongée par des îlots.
La vallée de stabilité proprement dite se termine au bismuth, au-delà duquel on ne trouve aucun nucléide stable[Note 1].
Au-delà du bismuth la courbe est interrompue et il n'existe aucun nucléide de période supérieure à 1 jour ayant entre 211 et 221 nucléons (inclus).
Au-delà de 221 nucléons, la courbe est prolongée par une zone de semi-stabilité, centré sur les actinides, où l'on trouve notamment le thorium 232, l'uranium 235 et 238, et le plutonium 244 considéré comme nucléide primordial[Note 2]. Au-delà, un autre îlot de stabilité est conjecturé, mais les isotopes correspondants n'ont pas été synthétisés.
Modélisation suivant la formule de Weizsäcker modifier
La formule de Weizsäcker peut être exploitée pour élaborer la relation donnant en fonction de pour les noyaux stables.
L'énergie de liaison s'écrit :
Elle peut être mise sous la forme suivante qui ordonne les termes en Z
Les noyaux stables sont ceux qui maximisent l'énergie de liaison .
Donc en dérivant par rapport à , on obtient une équation donnant les noyaux stables.
d'où :
en multipliant haut et bas par
Les valeurs des constantes utilisées sont (en MeV) :
Dans l'équation de la vallée de la stabilité seules les grandeurs et interviennent. Le constat d'une bonne adéquation de la relation ci-dessus avec la réalité (cf courbe ci-contre) justifie au 1er ordre la valeur du rapport des coefficients .
Le terme est petit devant 1.
Énergie de liaison maximale modifier
Pour alléger les calculs :
- on pose
- dont on remarque que est à peu près constant par zone ; par exemple pour
- on retient pour la recherche du maximum de
- on remarque que le terme est petit devant les autres soit moins de 1 % de la valeur de , dès lors que
On dérive cette relation par rapport à A en supposant constant[Note 3], il vient :
en multipliant cette équation par : on obtient la valeur du maximum de
La valeur trouvée est un peu élevée, elle "valide" cependant au 1er ordre le rapport [Note 4]
Rapport N/Z = modifier
On a toujours : avec donc :
et
On remarque sur le diagramme ci-contre que la proportion varie sensiblement pour les atomes de taille modérée et ne converge que progressivement vers 1,55 pour les atomes lourds.
Description des singularités modifier
Assemblages de nucléons modifier
Le nombre de nucléons varie de 1 à 209 nucléons[Note 1] Les assemblages de nucléons suivants n'ont pas de configuration stable :
- l'assemblage à 5 nucléons est rendu instable par la très grande stabilité du noyau d'hélium (l'hélium 5 a une demi-vie — si on ose dire — de 7,6 × 10-23 s ; le lithium 5 n'existe pas).
- de même pour l'assemblage à 8 nucléons (le béryllium 8 se fissionne spontanément en deux noyaux d'hélium avec une demi-vie de 6,7 × 10-17 s ; le lithium 8 n'existe pas)
- l'assemblage à 147 nucléons n'a pas de configuration stable (le samarium 147 de demi-vie 1,08 × 1011 a, n'est clairement pas stable) ; en revanche l'assemblage à 149 nucléons est stable sous la forme du samarium 149, dont la période est très supérieure à 1012 a.
Les configurations isobariques différentes (un même nombre total de nucléons pour des proportions variables de neutrons et protons) sont assez nombreuses. Elles concernent 60 assemblages assez régulièrement répartis entre 30 et 200 nucléons avec une concentration dans la plage 70 à 170 nucléons. Toutefois :
- elles ne concernent que les assemblages à nombre pairs de nucléons sauf pour les assemblages à 115 et 123 nucléons
- pour un même assemblage d'un nombre de nucléons donné, elles se limitent à deux répartitions différentes (neutrons/protons) sauf dans les assemblages à 50, 130, 136 et 180 nucléons qui présentent chacun trois répartitions isobariques distinctes, donc trois éléments chimiques différents pour un même nombre de nucléons dans le noyau :
À l'image du « plomb vil transformable en or pur » des alchimistes, ces configurations isobariques peuvent faire rêver même si l'or avec 79 protons + 118 neutrons est le seul isotope stable avec ce même nombre (197) de nucléons.
Composition en neutrons des assemblages stables modifier
En ce qui concerne les neutrons, entre l'unique neutron du deutérium et les 126 neutrons du plomb 208 et du bismuth 209, aucun assemblage à 19, 21, 35, 39, 45, 89, 115 et 123 neutron n'a de forme stable. Ces nombres apparaissent comme des nombres de neutrons « antimagiques ».
En suivant un peu finement les choses, on constate que les compositions en neutrons et protons évoluent suivant une courbe en « marches d'escalier ». Entre le noyau de l'atome de protium et le bismuth 209, on compte 50 « marches d'escalier » d'une hauteur moyenne de 126/50 = 2,52 neutrons et d'une longueur de 82 / 50 = 1,64 protons, sachant que l'ampleur des dites marches augmente avec la quantité totale de nucléons.
Composition en protons des assemblages stables modifier
En ce qui concerne les protons, entre l'hydrogène à un seul proton et le bismuth à 83 protons ; aucun assemblage à 43 protons (élément technétium) n'a de forme stable non plus qu'à 61 protons (élément prométhéum).
43 et 61 apparaissent comme des nombres de protons « antimagiques » de la série classique : 2, 8, 20, 28, 50, 82, 126
Compilation des isotopes stables modifier
Avec la convention retenue, savoir : demi-vie de l'isotope stable > 1012 a, on dresse la liste suivante :
- 1 élément (l'étain) a 10 isotopes stables
- 1 élément (le xénon) a 9 isotopes stables
- 2 éléments (le cadmium et le tellure) ont 8 isotopes stables ; total = 16
- 8 éléments ont 7 isotopes stables ; total = 56
- 7 éléments ont 6 isotopes stables ; total = 42
- 7 éléments ont 5 isotopes stables ; total = 35
- 6 éléments ont 4 isotopes stables ; total = 24
- 6 éléments ont 3 isotopes stables ; total = 18
- 19 éléments ont 2 isotopes stables ; total = 38
- 26 éléments ont 1 seul isotope stable
Les 26 derniers sont appelés éléments monoisotopiques.
Au total 81 éléments ont au moins un isotope stable. En moyenne donc 272 / 81 = 3,4 isotopes stables par élément chimique ayant au moins un isotope stable.
Radioactivité des isotopes modifier
Comme l'adret et l'ubac d'une vallée de montagne la vallée de stabilité sépare des zones de composition relative des noyaux en neutrons et protons dans lesquelles les modes de radioactivité sont différents.
Toutes les radioactivités corpusculaires tendent à faire revenir vers cette vallée les éléments qui les émettent, vallée qui correspond au minimum des énergies d'assemblage nucléaire. En règle générale, un isotope sera d'autant plus instable, donc d'autant plus radioactif, qu'il sera éloigné de cette vallée de stabilité.
- Les noyaux lourds (uranium et au-delà, pour lesquels N et Z sont grands donc A est grand) se désintègrent généralement suivant une radioactivité α, qui leur fait perdre deux neutrons et deux protons, et les rapproche de l'origine.
- Les noyaux qui présentent un excès de neutrons par rapport aux noyaux stables de même nombre de masse A sont situés au-dessus de la courbe. Ils sont l'objet d'une radioactivité β- : un neutron est converti en proton, expulsant du noyau un électron (et un antineutrino). Le nombre total de nucléons reste inchangé, mais Z augmente d'une unité et N diminue d'une unité. Le point représentatif du nucléide se déplace d'une case en diagonale vers la vallée.
- Les noyaux qui présentent un excès de protons par rapport aux noyaux stables de même nombre de masse A sont situés au-dessous de la courbe. Ils sont généralement l'objet d'une radioactivité β+ : un proton est converti en neutron, émettant un positron (et un neutrino)[Note 5]. Le nombre total de nucléons reste inchangé, mais Z diminue et N augmente. Le point représentatif du nucléide se déplace d'une case en diagonale (vers le haut et la gauche).
Pour des déséquilibres plus importants, d'autres formes de radioactivité peuvent apparaître : les atomes fortement déficitaires en neutrons peuvent expulser un proton, et inversement, les atomes fortement déficitaires en protons peuvent émettre un neutron.
Notes et références modifier
Notes modifier
- On a découvert en 2003 que le bismuth lui-même est très faiblement radioactif, avec une radioactivité alpha de 1,9 × 1019 ans. L'isotope complètement stable le plus lourd est donc le plomb 208. Toutefois, la demi-vie du bismuth 209 est très supérieure à 1012 a, donc l'assemblage de 83 protons et 126 neutrons est considéré comme stable dans l'analyse. Les conclusions seraient voisines si on admettait de considérer le bismuth 209 comme instable
- Tout en étant radioactifs, le thorium et l'uranium sont suffisamment stables pour se rencontrer dans la nature en quantité très significative.
- Une fois un premier calcul effectué il est aisément possible d'itérer sur le résultat en prenant une valeur plus correcte pour le terme et en négligeant le terme .
- Le jeu de constantes : proposé sur Wikipédia en allemand conduit à et une valeur de identique.
- Le positron (= antiélectron) ne quitte pas l'atome car une fois éjecté hors du noyau il réagit avec l'un des électrons du cortège électronique pour donner de l'énergie électromagnétique ; 511 keV exactement représentant l'équivalent en énergie de la masse d'un électron suivant la relation
Références modifier
Voir aussi modifier
Articles connexes modifier
- Radioactivité
- Îlot de stabilité
- Formule de Weizsäcker
- Modèle de la goutte liquide
- Nombre magique (physique)
- Carte des nucléides
- Structure nucléaire
- Modèle en couches
- Table des isotopes