Tolcapone
| Tolcapone | ||
| ||
 | ||
| Informations générales | ||
|---|---|---|
| Forme | Poudre cristalline jaune | |
| Administration | Voie orale | |
| Données physico-chimiques | ||
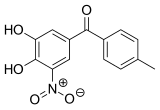
| Formule brute | C14H20NO5 | |
| Identification | ||
| Nom UICPA | (3,4-dihydroxy-5-nitrophényl)(4-méthylphényl)méthanone | |
| Synonymes |
Tasmar |
|
| No CAS | ||
| No ECHA | P2566 | |
| Code ATC | N04BX01 | |
| DrugBank | DB00323 | |
| modifier |
||
Le tolcapone (aussi connu sous la marque Tasmar) est un médicament utilisé pour traiter la maladie de Parkinson (PD). Il s'agit d'un inhibiteur sélectif, puissant et réversible de type nitrocatéchol de l'enzyme catéchol-méthyltransférase (COMT)[1]. Sa toxicité hépatique importante a été démontrée, ce qui a conduit à la suspension des autorisations de mise sur le marché dans un certain nombre de pays.
En comparaison avec l'entacapone, un autre inhibiteur du COMT du nitrocatéchol, le tolcapone a une demi-vie plus longue (2,9 heures contre 0,8 heure) et peut mieux pénétrer la barrière hémato-encéphalique, agissant à la fois dans le système nerveux central et à la périphérie[2]. Cependant, l'entacapone est moins toxique pour le foie.

Utilisations médicales modifier
La tolcapone est utilisée dans le traitement de la maladie de Parkinson en complément des médicaments à base de lévodopa / carbidopa ou de lévodopa / bensérazide. La lévodopa est un promédicament pour la dopamine, qui réduit les symptômes de Parkinson; la carbidopa et le bensérazide sont des inhibiteurs aromatiques de la L- aminoacide décarboxylase (AADC)[4].
Sans administration de tolcapone, les effets bénéfiques de la lévodopa ont tendance à disparaître plus rapidement, entraînant des fluctuations motrices[5].
Statut de médicament orphelin pour l'amylose à base de transthyrétine (TTR) modifier
En raison de données préliminaires suggérant que le médicament pourrait avoir une activité, la FDA américaine a étiqueté le tolcapone : "statut de médicament orphelin" dans des études visant le traitement de l'amylose familiale à transthyrétine (ATTR). Cependant, le tolcapone n'est pas approuvé par la FDA pour le traitement de cette maladie[6],[7].
Contre-indications modifier
L'association de tolcapone avec des inhibiteurs non sélectifs de la monoamine oxydase tels que la phénelzine ou la tranylcypromine est contre-indiquée[8]. Le tolcapone est également contre-indiqué pour les personnes atteintes de maladies hépatiques ou d'augmentation des enzymes hépatiques[9].
Effets néfastes modifier
Le tolcapone a démontré une toxicité hépatique significative (hépatotoxicité)[10] qui limite l'utilité du médicament. L'entacapone est une alternative, en grande partie parce qu'il a un profil de toxicité plus favorable.
L'hépatotoxicité peut être liée à des niveaux élevés de transaminases, mais des études ont montré qu'il existe un risque minimal pour ceux qui ne souffrent pas de troubles hépatiques préexistants lorsque leurs taux enzymatiques étaient surveillés. Aucun mécanisme clair n'est impliqué, mais il a été émis l'hypothèse qu'il a quelque chose à voir avec la respiration mitochondriale anormale en raison du découplage de la phosphorylation oxydative[11].
D'autres effets secondaires concernent l'augmentation de l'activité dopaminergique, y compris les symptômes digestifs[9]. Le traitement au tolcapone risque de provoquer ou de prolonger une dyskinésie ; cela peut être contrecarré en diminuant la dose de lévodopa. Cela se produit lorsque l'administration de tolcapone entraîne l'accumulation du donneur de méthyle biologique S- adénosyl- L- méthionine (SAM) dans le striatum qui induit des symptômes de Parkinson[11].
Les symptômes digestifs incluent la nausée et la diarrhée ; d'autres effets secondaires dopaminergiques incluent l'hypotension orthostatique, la bouche sèche, la transpiration et les étourdissements. Le tolcapone provoque une diarrhée plus sévère que l'entacapone ; c'était la raison la plus courante de l'arrêt du traitement dans les études[8]. La décoloration de l'urine provient du fait que les métabolites jaunes du tolcapone sont excrétés dans l'urine et n'est pas un signe inquiétant pour le sujet[9],[11].
Interactions modifier
Bien que l'augmentation des niveaux de dopamine soit une interaction souhaitée, le tolcapone peut théoriquement également augmenter les niveaux d'autres médicaments métabolisés par COMT, tels que les inhibiteurs de l'AADC carbidopa et benzerazide, ainsi que la méthyldopa, la dobutamine, l'apomorphine, l'adrénaline et l'isoprénaline. Dans les études, une légère interaction avec le benzerazide a été observée, mais pas avec la carbidopa. D'autres interactions avec ce groupe de médicaments n'ont pas été étudiées. Un type connexe d'interactions théoriques concerne les médicaments qui augmentent les concentrations de catécholamines, tels que les inhibiteurs de la monoamine oxydase (MAO) et les inhibiteurs de recapture de la noradrénaline ; ces derniers n'ont également montré que de légers effets dans la pratique. La combinaison avec des inhibiteurs non sélectifs de la MAO peut être dangereuse[8],[9].
En raison de son affinité pour l'enzyme hépatique CYP2C9, des interactions avec des médicaments métabolisés par cette enzyme sont également possibles, mais peu probables. Aucune interaction avec le tolbutamide, un substrat 2C9, n'a été observée dans les études[9].
Pharmacologie modifier
Mécanisme d'action modifier
Le tolcapone se lie de manière sélective et réversible[8] au site catalytique de COMT à la fois à la périphérie et au système nerveux central (SNC) avec une affinité plus grande que n'importe laquelle des trois catécholamines, y compris la lévodopa[12]. Il empêche ainsi la 3-O-méthylation de la lévodopa par COMT à la périphérie, ce qui produit la 3-O-méthyldopa, un métabolite majeur qui rivalise avec la lévodopa pour traverser la barrière hémato-encéphalique. Une plus grande partie de la lévodopa administrée atteint le SNC. De plus, la lévodopa qui a déjà atteint le SNC, après avoir été convertie en dopamine, ne sera pas dégradée aussi rapidement lorsque la tolcapone inhibe l'activité COMT. Ainsi, le tolcapone améliore la biodisponibilité et réduit la clairance de la lévodopa puis de la dopamine du SNC[13].
La force de l'affinité de liaison du tolcapone, représentée par la constante d'inhibition Ki (2,5 nM), peut être considérée comme la constante de dissociation de la cinétique du complexe enzymatique et inhibiteur. L'activité catalytique maximale indique l'efficacité du tolcapone (Vmax = 58,4 pmol/min mg)[14].
Pharmacocinétique modifier
Le tolcapone est rapidement absorbé par l'intestin à environ 85 %. Il a une biodisponibilité absolue de 65 %, qui n'est que légèrement diminuée lorsqu'il est pris avec de la nourriture. La substance atteint les concentrations plasmatiques sanguines les plus élevées après environ deux heures. Lorsqu'il est dans la circulation sanguine, il est presque entièrement (> 99,9 %) lié aux protéines plasmatiques, principalement à l'albumine. La principale étape d'inactivation est la glucuronidation ; d'autres processus sont la méthylation par COMT, l'hydroxylation par CYP3A4 et CYP2A6 avec oxydation subséquente en acide carboxylique, et éventuellement une voie mineure avec réduction en amine avec acétylation ultérieure[8],[9].
La demi-vie du tolcapone est de deux à trois heures, le volume de distribution (Vd) étant de 0,3 L/kg (21 L en moyenne pour une personne de 70 kg)[5]. 60 % des métabolites sont excrétés par l'urine et 40 % par les fèces. Seulement 0,5 % du médicament est excrété sous forme inchangée via l'urine[8],[9].
99 % du tolcapone est sous forme mono anionique dans le corps car le pH physiologique est de 7,4. Le tolcapone pénètre beaucoup mieux dans la barrière hémato-encéphalique que deux autres nitrocatéchols, le nitécapone et l'entacapone, car il présente une lipophilicité plus élevée en raison de son substituant R. coefficients de partition quantifient la capacité de la molécule à traverser la barrière hémato-encéphalique. LogPIdce = 0,2, –1,4 et –0,4 pour le tolcapone, le nitecapone et l'entacopone respectivement. Dans ce cas, les coefficients de partage ont été mesurés dans une solution de 1,2-dichloroéthane/H2O, ce qui a provoqué l'ionisation des molécules. Il n'y a aucune explication actuelle sur la façon dont ces molécules chargées imprègnent la barrière hémato-encéphalique[15].
Chimie modifier
Le tolcapone est un composé cristallin intensément jaune, inodore, au goût amer, non hygroscopique, d'une masse moléculaire relative de 273,25 g/mol. Il fond de 143 à 146 °C et est pratiquement insoluble dans l'eau et les solutions acides. Mais il reste soluble dans 0,1 M de solution aqueuse d'hydroxyde de sodium. Les valeurs de pKa sont de 4,5 et 10,6 pour les deux groupes phényle ; et l'absorption maximale est de 268 nm (avec 0,1 M de mélange acide chlorhydrique/éthanol)[8]. Son nom chimique est 3,4-dihydroxy-4'-méthyl-5-nitrobenzophénone.
Synthèse modifier
Une synthèse de tolcapone proposée en 2008 débute par une réaction de Grignard entre un dérivé de benzaldéhyde et du bromure de p-tolyl magnésium. L'alcool ainsi produit est ensuite transformé en cétone à l'aide de t- butoxyde de sodium. Le groupe protecteur benzyle est éliminé par hydrogénation catalysée au palladium en présence de formiate d'ammonium. Un groupe nitro est introduit en position 5 à côté du groupe hydroxyle non masqué lors du clivage de l'éther benzylique. La synthèse se termine par le clivage du groupe méthoxy en utilisant du chlorure d'aluminium pour donner l'alcool produit[16].
Histoire modifier
Le tolcapone a été introduit sur le marché européen en , puis sur le marché américain en . Une toxicité hépatique a été rapportée chez quatre personnes à qui on a administré du tolcapone, trois personnes sont décédées des suites de complications. En conséquence, l'autorisation de mise sur le marché du tolcapone a été suspendue de à , date à laquelle elle a été levée. En , la société qui fabriquait volontairement du tolcapone[17] retiré le médicament du marché. L'autorisation a ensuite été renouvelée en [18].
À la suite de complications signalées, la Food and Drug Administration (FDA) des États-Unis a publié une mise en garde concernant le tolcapone et des révisions d'étiquettes visant à réglementer la surveillance des tolcapones prescrits pour la maladie de Parkinson en [19] Un certain nombre d'autres pays ont retiré le tolcapone du marché; Australie en , Bulgarie en , Islande en , Lituanie en [17]
Notes et références modifier
- Antonini, Abbruzzese, Barone et Bonuccelli, « COMT inhibition with tolcapone in the treatment algorithm of patients with Parkinson's disease (PD): Relevance for motor and non-motor features », Neuropsychiatric Disease and Treatment, vol. 4, no 1, , p. 1–9 (PMID 18728767, PMCID 2515921, DOI 10.2147/NDT.S2404)
- Forsberg, Lehtonen, Heikkinen et Savolainen, « Pharmacokinetics and Pharmacodynamics of Entacapone and Tolcapone after Acute and Repeated Administration: A Comparative Study in the Rat », Journal of Pharmacology and Experimental Therapeutics, vol. 304, no 2, , p. 498–506 (PMID 12538800, DOI 10.1124/jpet.102.042846)
- M. Ellermann, C. Lerner, G. Burgy et A. Ehler, « Catechol-O-methyltransferase in complex with substituted 3′-deoxyribose bisubstrate inhibitors », Acta Crystallographica D, vol. 68, no 3, , p. 253–260 (PMID 22349227, DOI 10.1107/S0907444912001138)
- J. Dingemanse, K. Jorga, G. Zurcher et M. Schmitt, « Pharmacokinetic-pharmacodynamic interaction between the COMT inhibitor tolcapone and single-dose levodopa », British Journal of Clinical Pharmacology, vol. 40, no 3, , p. 253–262 (PMID 8527287, PMCID 1365105, DOI 10.1111/j.1365-2125.1995.tb05781.x)
- Jorga, Fotteler, Heizmann et Zürcher, « Pharmacokinetics and pharmacodynamics after oral and intravenous administration of tolcapone, a novel adjunct to Parkinson's disease therapy », European Journal of Clinical Pharmacology, vol. 54, no 5, , p. 443–447 (PMID 9754991, DOI 10.1007/s002280050490)
- orphan drug status for tolcapone
- Reig, Ventura, Salvadó et Gámez, « SOM0226, a repositioned compound for the treatment of TTR amyloidosis », Orphanet J Rare Dis, vol. 10, no Suppl 1, , P9 (PMCID 4642128, DOI 10.1186/1750-1172-10-s1-p9)
- (de) Arzneistoff-Profile, vol. 10, Eschborn, Germany, , 13e éd. (ISBN 978-3-7741-9846-3)
- « Tasmar: EPAR – Product Information », Agence européenne des médicaments,
- Olanow et Watkins, « Tolcapone », Clinical Neuropharmacology, vol. 30, no 5, , p. 287–294 (PMID 17909307, DOI 10.1097/wnf.0b013e318038d2b6)
- Truong, « Tolcapone: Review of its pharmacology and use as adjunctive therapy in patients with Parkinson's disease », Clinical Interventions in Aging, vol. 4, , p. 109–113 (PMID 19503773, PMCID 2685232, DOI 10.2147/CIA.S3787)
- Deleu, Northway et Hanssens, « Clinical Pharmacokinetic and Pharmacodynamic Properties of Drugs Used in the Treatment of Parkinson's Disease », Clinical Pharmacokinetics, vol. 41, no 4, , p. 261–309 (PMID 11978145, DOI 10.2165/00003088-200241040-00003)
- K. Jorga, B. Fotteler, P. Heizmann et R. Gasser, « Metabolism and excretion of tolcapone, a novel inhibitor of catechol-O-methyltransferase », British Journal of Clinical Pharmacology, vol. 48, no 4, , p. 513–520 (PMID 10583021, PMCID 2014389, DOI 10.1046/j.1365-2125.1999.00036.x)
- Forsberg, Huotari, Savolainen et Männistö, « The role of physicochemical properties of entacapone and tolcapone on their efficacy during local intrastriatal administration », European Journal of Pharmaceutical Sciences, vol. 24, no 5, , p. 503–511 (PMID 15784340, DOI 10.1016/j.ejps.2005.01.005)
- Novaroli, Bouchard Doulakas, Reist et Rolando, « The Lipophilicity Behavior of Three Catechol-O-methyltransferase (COMT) Inhibitors and Simple Analogues », Helvetica Chimica Acta, vol. 89, no 1, , p. 144–152 (DOI 10.1002/hlca.200690007)
- Manikumar, Jin et Rehder, « Convenient Synthesis of Tolcapone, a Selective Catechol‐O‐methyltransferase Inhibitor », Synthetic Communications, vol. 38, no 5, , p. 810 (DOI 10.1080/00397910701821077)
- « 2001 Pharmaceuticals: Restrictions in Use and Availability », Organisation mondiale de la santé (consulté le )
- « Tasmar tolcapone EPAR summary for the public », Agence européenne des médicaments (consulté le )
- Press Office, « FDA Talk Paper », New Warnings for Parkinson's Drug, Tasmar, Food and Drug Administration