Octachlorodirhénate de potassium
| Octachlorodirhénate de potassium | |
| |
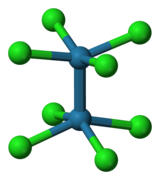
| Structure de l'anion Re2Cl82−. | |
| Identification | |
|---|---|
| Nom UICPA | octachlorodirhénate de potassium |
| No CAS | |
| Apparence | solide bleu |
| Propriétés chimiques | |
| Formule | K2Re2Cl8 |
| Masse molaire[1] | 734,235 ± 0,018 g/mol Cl 38,63 %, K 10,65 %, Re 50,72 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'octachlorodirhénate de potassium est un composé inorganique de formule K2Re2Cl8. Ce sel bleu foncé est connu comme un des premiers composés identifiés comportant une liaison quadruple entre ses centres métalliques. Bien que le composé n'ait aucune valeur pratique, sa caractérisation a été importante pour ouvrir un nouveau champ de recherche sur les complexes à liaison quadruple[2].
Synthèse et réactions modifier
Les chimistes soviétiques ont rapporté pour la première fois l'existence de l'octachlorodirhénate de potassium(III) en 1954[3] mais ce n’est qu’en 1964 que Cotton et Harris ont décrit le composé comme comportant une courte liaison Re-Re, le premier du genre découvert[4]. Les résultats de cette étude ont ensuite conduit à de nouveaux travaux sur d'autres métaux capables de former des liaisons métal-métal, tels que le chrome, le molybdène, le tungstène et le technétium[5],[6],[7].
Une synthèse à haut rendement du sel de tétrabutylammonium implique le traitement du sel de perrhénate ReO4− avec du chlorure de benzoyle, puis avec HCl :
L'octachlorodirhénate de potassium(III) est un précurseur d'autres complexes de rhénium à liaisons multiples, car la liaison quadruple est assez stable et est souvent conservée dans les réactions de substitution de ligands. Par exemple, lors du traitement avec du bromure d'hydrogène concentré, le complexe forme l'anion analogue [Re2Br8]2−, qui peut facilement être converti en d'autres composés à base de dirhénium[8].
Structure et formation de liaisons modifier
Dans le [Re2Cl8]2−, la longueur de liaison Re–Re est de 2,24 Å, les angles de liaison Re–Re–Cl sont de 104° et les angles Cl–Re–Cl sont de 87°. Les ligands chlorure sont en conformation éclipsée. Bien que cette géométrie entraîne des interactions répulsives entre les ions chlorure, cette conformation permet un chevauchement δ–δ maximal entre les centres Re (III), facteur qui annule les répulsions défavorables des chlorures. L'anion [Re2Cl8]2− a un caractère électrophile faible[2],[9]. Avec sa configuration, le Re (III) est bien adapté pour former une liaison quadruple. Les électrons sont dans la configuration σ2π4δ2, ce qui donne un ordre de liaison de 4 entre les atomes de rhénium. La couleur brillante du [Re2Cl8]2− est due à la transition électronique δ→δ*[8].
Notes et références modifier
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) F. A. Cotton et R. A. Walton, Multiple Bonds Between Metal Atoms, Oxford, Oxford University Press, , 787 p. (ISBN 0-19-855649-7)
- Лидин Р.А., Андреева .Л., Молочко В.А. Константы неорганических веществ. (1954) 2: 161
- Cotton et Harris, « The Crystal and Molecular Structure of Dipotassium Octachlorodirhenate(III) Dihydrate, K2[Re2Cl8]·2H2O », Inorg. Chem., vol. 4, no 3, , p. 330–333 (DOI 10.1021/ic50025a015)
- Hao, Gambarotta et Bensimon, « Reversible cleavage of chromium–chromium quadruple bond of [Me8Cr2][Li(THF)]4 via modification of the coordination sphere of the alkali cation. Preparation and crystal structure of monomeric [Me4Cr][Li(TMEDA)]2 », J. Am. Chem. Soc., vol. 114, , p. 3556–3557 (DOI 10.1021/ja00035a061)
- Cotton, Eglin, Hong et James, « Singlet–triplet separations measured by phosphorus-31 nuclear magnetic resonance spectroscopy. Applications to the molybdenum–molybdenum quadruple bond and to edge-sharing bioctahedral complexes », J. Am. Chem. Soc., vol. 114, , p. 4915–4917 (DOI 10.1021/ja00038a074)
- F. A., H., L. M. et X., « Partial paramagnetism of the chromium–chromium quadruple bond », J. Am. Chem. Soc., vol. 114, , p. 8980–8983 (DOI 10.1021/ja00049a031)
- Barder et Walton, « Tetrabutylammonium Octachlorodirhenate(III) », Inorg. Synth., vol. 23, , p. 116–118 (DOI 10.1002/9780470132548.ch22)
- Shtemenko, Kozhura, Pasenko et Domasevich, « New octachlorodirhenate(III) salts: solid-state manifestation for a certain conformational flexibility of the [Re2Cl8]2− ion », Polyhedron, vol. 22, no 12, , p. 4191–4196 (DOI 10.1016/S0277-5387(03)00288-2)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Potassium octachlorodirhenate » (voir la liste des auteurs).