Hsp70
HSP signifie protéines de choc thermique (heat shock proteins). Ce sont en fait des protéines chaperonnes, de classe 1. En effet, elles sont garantes de la bonne conformation des protéines de la cellule, et les aide à se protéger des stress externes[1],[2]. Le suffixe « 70 » correspond au poids moléculaire (70 kdaltons)
Découverte modifier
Les membres de la famille Hsp70 sont fortement régulatrices du stress dû à la chaleur et les produits chimiques toxiques, en particulier les métaux lourds comme l'arsenic, le cadmium, cuivre, mercure, etc. Hsp70 a été initialement découverte par Ferrucio Ritossa (1936-2014) dans les années 1960 quand un travailleur de laboratoire a accidentellement augmenté la température d'incubation d'une culture de Drosophiles (mouches des fruits). Lors de l'examen des chromosomes, Ritossa a trouvé une augmentation de la transcription des gènes d'une protéine inconnue[3],[4]. Cela fut plus tard décrit comme la «Heat Shock Response» et les protéines ont été appelées « Heat Shock Proteins » (Hsps).
Structure modifier
Fonctionnement général modifier
Les protéines de la famille des HSP70 fonctionnent sous forme de dimères. Elles ont un fonctionnement fondé sur leur flexibilité et leur capacité à lier des zones d'interactions hydrophobe. on distingue deux cas :
- si la protéines est labile (facilement modifiable), l'ATP ne sera pas nécessaire ;
- alors que si la protéines est structurée de manière forte, l'ATP devra intervenir.
Structure modifier
Toutes les protéines Hsp70 ont trois grands domaines fonctionnels :
- un « domaine N-terminal » du domaine ATPase lie l'ATP (adénosine triphosphate) et l'hydrolyse en ADP (adénosine diphosphate). L'échange de l'ATP réalise des changements conformationnels dans les deux autres domaines ;
- un « domaine de fixation du substrat » avec une affinité pour les molécules neutres, d'acides aminés hydrophobes résidus. Le domaine est suffisamment long pour interagir avec des peptides jusqu'à sept résidus de longueur ;
- un « domaine C-terminal » riche en structure en hélice alpha, qui agit comme un « couvercle » pour le domaine de fixation du substrat. Quand une protéine Hsp70 est liée à l'ATP, le couvercle est ouvert et relâche relativement rapidement le peptide. Lorsque les protéines Hsp70 sont liées à l'ADP, le couvercle est fermé, et les peptides sont étroitement liés au domaine de fixation du substrat.
Fonction et régulation modifier
La chaleur est un des plus grands ennemis des protéines puisque cela modifie le repliement et par conséquent, altère la fonction de la protéine. Dès lors, l'évolution a mis en place des systèmes permettant d'éviter cette dénaturation par la chaleur pour ne pas avoir à remplacer trop souvent les protéines dénaturées (le recyclage des protéines est appelé le « turn-over »). Le rôle des HSP est de garantir la bonne conformation des protéines dans la cellule.
Les HSP se distinguent par le fait qu'elles possèdent plus d'acides aminés capables d'établir de fortes interactions entre eux que les protéines « normales », c'est-à-dire, non-HSP. Par conséquent, les HSP sont donc moins « flexibles » et moins sensibles à la chaleur.
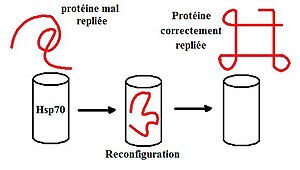
Concrètement, une HSP s'approche d'une protéine. Selon que la conformation de la protéines est bonne ou mauvaise, elle permettra ou non l'association de la HSP ou sera dirigée vers le protéasome pour être dégradée. Si la HSP s'est associée, cette dernière va servir de « squelette » à la protéine ce qui lui évite de se faire déformer (dénaturer) par la chaleur. Plus tard, les deux protéines se séparent et continuent leur vie dans la cellule.
Le terme « HSP » regroupe en fait toute une famille de protéines, chacune ayant un partenaire protéique spécifique. Certaines HSP sont exprimées (synthétisées) tout le temps alors que d'autres sont exprimées à la suite d'une brusque augmentation de la température.
Cancer modifier
HSP 70 est surexprimé dans les mélanomes malins et sousexprimé dans les cellules rénales cancéreuses.
Membre de la famille modifier
Les procaryotes expriment trois protéines Hsp70: DnaK, HscA (Hsc66), et HscC (Hsc62)[5].
Les organismes eucaryotes expriment plusieurs protéines Hsp70 légèrement différentes (car très conservées au cours de l'évolution étant donné qu'elles sont essentielles). Toutes partagent la même structure de domaine, mais chacune a un modèle unique d'expression.
- Hsc70 (Hsp73/HSPA8) est constitutivement dite protéine chaperon. Elle représente généralement 1 à 3% du total des protéines cellulaires.
- Hsp72 (HSPA1A) est une protéine induite par le stress. Des concentrations élevées peuvent être produites par les cellules en réponse à une hyperthermie, un stress oxydatif, et des changements de pH.
- Binding immunoglobulin protein (BIP ou Grp78) est une protéine localisée au niveau du réticulum endoplasmique. Elle est impliquée dans le repliement des protéines, et sa concentration et fonction varie en réponse au stress ou à la famine.
- mtHsp70 ou Grp75 est la Hsp70 mitochondriale.
Ce qui suit est une liste des gènes d'Hsp70 de l'homme et de leurs protéines correspondantes[1]:
| gène | protéine | synonymes | localisation cellulaire |
|---|---|---|---|
| HSPA1A | Hsp70-1a | HSP70-1, Hsp72 | Noyau/Cyto |
| HSPA1B | Hsp70-1b | HSP70-2 | Nuc/Cyto |
| HSPA1L | Hsp70-1L | ? | |
| HSPA2 | Hsp70-2 | ? | |
| HSPA4 | Hsp70-4 | ? | |
| HSPA4L | Hsp70-4L | ? | |
| HSPA5 | Hsp70-5 | BiP/Grp78 | ER |
| HSPA6 | Hsp70-6 | ? | |
| HSPA7 | Hsp70-7 | ? | |
| HSPA8 | Hsp70-8 | Hsc70 | Nuc/Cyto |
| HSPA9 | Hsp70-9 | Grp75/mtHsp70 | Mito |
| HSPA12A | Hsp70-12a | ? | |
| HSPA14 | Hsp70-14 | ? |
Notes et références modifier
- (en) Tavaria M, Gabriele T, Kola I, Anderson RL, « A hitchhiker's guide to the human Hsp70 family », Cell Stress Chaperones, vol. 1, no 1, , p. 23–8 (PMID 9222585, PMCID 313013)
- (en) Morano KA, « New tricks for an old dog: the evolving world of Hsp70 », Ann. N. Y. Acad. Sci., vol. 1113, , p. 1–14 (PMID 17513460, DOI 10.1196/annals.1391.018)
- (en) Ritossa F, « A new puffing pattern induced by temperature shock and DNP in drosophila », Cellular and Molecular Life Sciences (CMLS), vol. 18, no 12, , p. 571-573 (DOI 10.1007/BF02172188)
- (en) Ritossa F, « Discovery of the heat shock response », Cell Stress Chaperones, vol. 1, no 2, , p. 97–8 (PMID 9222594, PMCID 248460)
- (en) Yoshimune K, Yoshimura T, Nakayama T, Nishino T, Esaki N, « Hsc62, Hsc56, and GrpE, the third Hsp70 chaperone system of Escherichia coli », Biochem. Biophys. Res. Commun., vol. 293, no 5, , p. 1389–95 (PMID 12054669, DOI 10.1016/S0006-291X(02)00403-5)
Liens externes modifier
- Ressource relative à la santé :