Fièvre hémorragique virale
| Spécialité | Infectiologie |
|---|
| CIM-10 | A96-A99 |
|---|---|
| eMedicine | 830594 |
| MeSH | D006482 |
La fièvre hémorragique virale (FHV) désigne un ensemble de maladies diverses, causées par des virus non apparentés.
Elles sont la plupart du temps bénignes, voire passent inaperçues, mais elles sont toutes potentiellement graves, avec pour certaines des taux de mortalité importants. Comme chez tous les virus, des variants différents (plus ou moins pathogènes ou virulents) peuvent coexister ou apparaître à la suite de la réponse immunitaire des hôtes infectés[1].
Certaines sont considérées comme maladies émergentes[2] ou émergentes potentielles, ou susceptibles d'être utilisées comme arme biologique[3] (avec risque qu'elles se retournent contre leurs utilisateurs).
Les « virus hémorragiques » les plus dangereux semblent compter parmi la famille des rhabdovirus, famille très variée encore incomplètement explorée[4] qui touche à la fois des animaux (dont poissons[5]) et des plantes[6].
Les virus impliqués sont tous des virus à ARN et appartiennent à diverses familles (Flaviviridae, Bunyaviridae, Filoviridae, Arenaviridae). Au plan épidémiologique, on distingue entre les virus transmis par des Arthropodes (moustiques ou tiques, responsables d'arboviroses), les virus à réservoir animal (rongeurs ou chauve-souris) et les FHV de réservoir inconnu.
Distribution géographique modifier
Elle est généralement bien délimitée, mais non circonscrites aux zones tropicales comme on le croit souvent. Les réservoirs des virus sont a priori toujours animaux, mais parfois ne sont pas identifiés.[réf. nécessaire] La transmission de l'animal-réservoir à l'humain se fait soit de façon indirecte, par un vecteur comme le moustique dans le cas des arboviroses, soit directe par exposition aux produits biologiques de l'animal infectés par le virus, par exemple les déjections des rongeurs porteurs (Arenaviridae, Hantavirus, Filoviridae).[réf. nécessaire]
Détection modifier
Elle est réalisée par les épidémiologistes, au vu des symptômes et des épidémies déclarées. La RT-PCR a permis d'accélérer la reconnaissance et le suivi des souches connues, comme pour le virus Ebola[7] ou de Durham[8].
Traitements modifier
Dans la plupart des cas, il n'existe pas de traitement spécifique homologué. La prévention repose sur les vaccins lorsqu'ils existent et sur des mesures d'hygiène et de sécurité. Les fièvres hémorragiques virales africaines les plus connues sont la maladie à virus Ebola et la fièvre hémorragique de Marbourg.[réf. nécessaire]
Clinique modifier
L'incubation est en moyenne de 3 à 7 jours, avec un maximum de 21 jours pour la maladie à virus Ebola. La phase d'invasion est marquée par un syndrome pseudogrippal. Une éruption maculeuse oriente vers une arbovirose (syndrome algoéruptif). Une pharyngite, une hyperhémie conjonctivale, voire un œdème facial sont évocateurs.[réf. nécessaire]
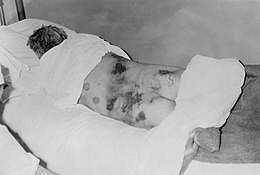
À la phase d'état, le tableau peut se compliquer d'un syndrome hémorragique, pouvant mener à une défaillance multiviscérale, rapidement mortelle. Ces hémorragies sont inconstantes : 1 % pour la fièvre de la vallée du Rift, 20 % à 80 % pour Ebola[réf. souhaitée].
Diagnostic modifier
Même si la présentation clinique et l'enquête épidémiologique (séjour en zone d'endémie, exposition au risque) sont des éléments essentiels pour suspecter l'étiologie d'une fièvre hémorragique virale, il est le nécessaire d'avoir recours aux examens biologiques pour obtenir un diagnostic de certitude : une sérologie à la recherche d'anticorps signant une infection récente (IgM) est intéressante lorsqu'elle est positive, mais cette preuve, indirecte, n'est pas toujours suffisante. Compte tenu de la possibilité de réactions croisées (entre les différents flavirus, par exemple), le diagnostic de certitude nécessite un examen de génie moléculaire (RT-PCR, GeneXpert), l'isolement ou le génotypage du virus en cause.
Classifications de l'OMS des virus à fièvres hémorragiques modifier
D'autres virus hémorragiques sont en cours d'étude, dont Lujo mammarenavirus[9].
Un nouveau virus de la famille des Rhabdoviridae dit virus du bassin du Congo (BASV) a été identifié, en 2009, à la suite de la survenue de trois cas humains de fièvre hémorragique particulièrement aigüe (village de Mangala, en RDC). Le génome du BASV diffère fortement de celui des autres rhabdovirus. Le réservoir naturel et le mode de transmission de ce virus demeurent inconnus[10].
Notes et références modifier
- Grard G, Biek R, Muyembe Tamfum JJ, Fair J, Wolfe N, et al. (2011) Emergence of divergent zaire ebola virus strains in democratic republic of the congo in 2007 and 2008. J Infect Dis 204 Suppl 3: S776–784. doi: 10.1093/infdis/jir364.
- Geisbert TW, Jahrling PB (2004) Exotic emerging viral diseases: progress and challenges. Nat Med 10: S110–121. doi: 10.1038/nm1142
- Borio L, Inglesby T, Peters CJ, Schmaljohn AL, Hughes JM, et al. (2002) Hemorrhagic fever viruses as biological weapons: medical and public health management. JAMA 287: 2391–2405. doi: 10.1001/jama.287.18.2391
- Kuzmin IV, Novella IS, Dietzgen RG, Padhi A, Rupprecht CE (2009) The rhabdoviruses: biodiversity, phylogenetics, and evolution. Infect Genet Evol 9: 541–553. doi: 10.1016/j.meegid.2009.02.005.
- Hoffmann B, Beer M, Schutze H, Mettenleiter TC (2005) Fish rhabdoviruses: molecular epidemiology and evolution. Curr Top Microbiol Immunol 292: 81–117.
- Fu ZF (2005) Genetic comparison of the rhabdoviruses from animals and plants. Curr Top Microbiol Immunol 292: 1–24.
- Towner JS, Rollin PE, Bausch DG, Sanchez A, Crary SM, et al. (2004) Rapid diagnosis of Ebola hemorrhagic fever by reverse transcription-PCR in an outbreak setting and assessment of patient viral load as a predictor of outcome. J Virol 78: 4330–4341. doi: 10.1128/JVI.78.8.4330-4341.2004
- Allison AB, Palacios G, Travassos da Rosa A, Popov VL, Lu L, et al. (2011) Characterization of Durham virus, a novel rhabdovirus that encodes both a C and SH protein. Virus Res 155: 112–122. doi: 10.1016/j.virusres.2010.09.007
- (en) Briese T, Paweska JT, McMullan LK, Hutchison SK, Street Cet al. « Genetic detection and characterization of Lujo virus, a new hemorrhagic fever-associated arenavirus from southern Africa » PLoS Pathog 2009;5:e1000455. DOI 10.1371/journal.ppat.1000455
- Grard G, Fair JN, Lee D, Slikas E, Steffen I, et al. (2012), A Novel Rhabdovirus Associated with Acute Hemorrhagic Fever in Central Africa ; PLoS Pathogens doi:10.1371/journal.ppat.1002924 September 27, 2012
Annexes modifier
Articles connexes modifier
- Peste porcine africaine (fièvre hémorragique virale animale)
- Virus
- Fièvre
- Épidémiologie, écoépidémiologie,
- Zoonoses
Bibliographie modifier
- Bray M (2005) Pathogenesis of viral hemorrhagic fever. Curr Opin Immunol 17: 399–403. doi: 10.1016/j.coi.2005.05.001.
- Carrion R, Patterson JL (2011) Vaccines against viral hemorrhagic fevers: non-human primate models. Hum Vaccin 7: 667–673. doi: 10.4161/hv.7.6.14981.
- Warrell MJ, Warrell DA (2004) Rabies and other lyssavirus diseases. Lancet 363: 959–969
- Rodriguez LL (2002) Emergence and re-emergence of vesicular stomatitis in the United States. Virus Res 85: 211–219. doi: 10.1016/S0168-1702(02)00026-6
- Gubala AJ, Proll DF, Barnard RT, Cowled CJ, Crameri SG, et al. (2008) Genomic characterisation of Wongabel virus reveals novel genes within the Rhabdoviridae. Virology 376: 13–23. doi: 10.1016/j.virol.2008.03.004.
- Fu ZF (2005) The world of rhabdoviruses. Berlin; New York: Springer. vi, 208 p.
- Brooks JT, Shapiro RL, Kumar L, Wells JG, Phillips-Howard PA, et al. (2003) Epidemiology of sporadic bloody diarrhea in rural Western Kenya. Am J Trop Med Hyg 68: 671–677
Liens externes modifier
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Rubrique sur les fièvres virales hémorragiques du site de l'Organisation Mondiale de la Santé (OMS).
- Sélections de sources francophones sur les fièvres hémorragiques virales validées par CISMef
- Fièvres virales transmises par des arthropodes et fièvres virales hémorragiques(A90-A99) de la Classification de l'OMS (CIM-10).