Diphosphane
| Diphosphane | |
  |
|
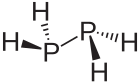
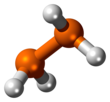
| Structure du diphosphane. La représentation 3D à droite est la plus proche de la conformation réelle de la molécule. | |
| Identification | |
|---|---|
| Synonymes |
diphosphine |
| No CAS | |
| PubChem | 139283 |
| ChEBI | 35880 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | P2H4 |
| Masse molaire[1] | 65,979 28 ± 0,000 28 g/mol H 6,11 %, P 93,89 %, |
| Propriétés physiques | |
| T° fusion | −99 °C[2] |
| T° ébullition | 58,5 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le diphosphane, ou la diphosphine, est un composé chimique de formule P2H4. C'est l'analogue phosphoré de l'hydrazine N2H4. Il se présente sous la forme d'un liquide pyrophorique incolore qui contamine souvent les échantillons de phosphine PH3 et provoque leur inflammation spontanée. Il se dismute en phosphine et phosphanes plus lourds à une température supérieure à −30 °C[3]. La molécule adopte une conformation gauche semblable à celle de la molécule d'hydrazine. La longueur de la liaison P–P est de 221,9 pm. Très instable à température ambiante, il se décompose en présence de traces d'acide aux températures supérieures à −10 °C, et ce d'autant plus facilement qu'il est exposé à la lumière. Il est peu soluble dans l'eau mais se dissout davantage dans les solvants organiques. Il est miscible avec le disulfure de carbone, la pyridine, les hydrocarbures, les éthers, le 2-(2-méthoxyéthoxy)éthanol et le diglyme, et est soluble dans le méthanol[4].
Le diphosphane peut être obtenu par hydrolyse du monophosphure de calcium (en) Ca2P2 :
L'hydrolyse de 400 g de Ca2P2 peut donner jusqu'à 20 g de P2H4 légèrement contaminé par d'autres phosphanes[3].
La réaction du diphosphane avec le n-butyllithium LiCH2CH2CH2CH3 conduit à divers polyphosphanes condensés[5].
On connaît plusieurs dérivés organiques du diphosphane. Les atomes d'hydrogène peuvent être partiellement en entièrement substitués par des radicaux organyle. Ces dérivés sont synthétisés par couplage réducteur, par exemple avec la chlorodiphénylphosphine ClPPh2 :
Notes et références modifier
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Dexter Harvey et Nicky Rutledge, Industrial Chemistry, ED-Tech Press, Royaume-Uni, 2019, p. 265. (ISBN 978-1-83947-197-1)
- (de) A. F. Holleman, E. Wiberg et N. Wiberg, Lehrbuch der Anorganischen Chemie, 101e éd., Walter de Gruyter, Berlin 1995, p. 745. (ISBN 3-11-012641-9)
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. I, Ferdinand Enke, Stuttgart 1975, p. 516. (ISBN 3-432-02328-6)
- (de) Peter Paetzold, Chemie, de Gruyter, Berlin 2009, p. 658. (ISBN 978-3-11-020268-7)