Coquille de gastéropode
De nombreuses espèces de gastéropodes sont munies d'une coquille extérieure plus ou moins importante : atrophiée chez les limaces, voire internalisée, elle est assez grosse pour abriter l'animal entier chez les escargots par exemple ; elle constitue alors une protection contre les prédateurs et la sécheresse. Ces coquilles, dites univalves, présentent des particularités par rapport aux coquilles des autres mollusques qui sont des organismes calcicoles facultatifs ou obligatoires (calcaire obtenu dans les plantes dont ils se nourrissent ou en raclant les substrats minéraux calcaires), plus rarement calcifuges et dans les régions à sol non calcaire où ils peuvent ronger la coquille d'autres individus (cas de parasitisme), d'os, de coquilles d'œufs[1].
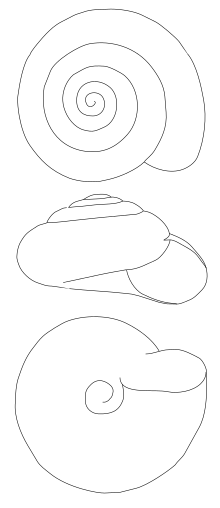
La coquille est sécrétée par un épais pli de peau, appelé le manteau. Elle est composée principalement de carbonate de calcium de type aragonite. Les gastéropodes ont donc besoin d'une alimentation riche en calcium.
La forme de la coquille « turbinée » (en cornet) ou « hélicospirale » (spirale hélicoïdale) des gastéropodes, ou de la coquille « discoïde » ou « planispirale » des céphalopodes, permet à ces mollusques de gagner en compacité mais aussi en résistance[2]. Plusieurs lignées évolutives indépendantes de mollusques ont en effet développé des coquilles de plus en plus épaisses avec des spires de plus en plus longues, des sculptures (lamelles, côtes, stries radiales ou spirales) de plus en plus fortes, et des possibilités d'ouverture de plus en plus difficiles à broyer, stratégie évolutive pouvant être considérée comme une course aux armements entre les prédateurs et les proies[3].
Croissance modifier
À la naissance, le petit a une coquille qui constituera l'apex de la coquille adulte, la protoconque (ou coquille larvaire). Ensuite, la croissance n'est ni continue, ni régulière. Elle peut ralentir voire s'interrompre lors des périodes d'inactivité et de jeûne de l'animal, notamment en hiver ou en cas de sécheresse prolongée. Ces irrégularités se manifestent par la formation de stries de croissance souvent visibles sur la surface.
Comme chez les autres mollusques, la coquille comporte trois couches minérales : une couche externe pigmentée, ou conchyoline, une couche intermédiaire calcaire et, enfin, une couche de nacre lisse qui est au contact du corps de l’animal. Elle est revêtue d'une pellicule externe, très fine, le périostracum, sécrétée avant les couches minérales. En cours de croissance les mollusques ont une coquille dont le bord est très fragile. Chez certaines espèces (par exemple Zenobiellina subrufescens (en), sur la façade atlantique de l'Europe), les couches internes sont très minces, ce qui confère à la coquille un aspect et une consistance cornées. Le périostracum présente fréquemment des expansions ayant l'allure de soies ou d'épines. À la mort de l'animal, il disparaît le premier du fait de sa nature organique. Les couleurs s'estompent donc très vite : ne subsiste alors que la coquille calcaire, qui peu à peu devient entièrement blanche.
Certains escargots ont une coquille très dure, y compris en zone tropicale où le calcium est rare dans le sol, d'autres espèces, généralement aquatiques ou palustres ont une coquille plus fine et fragile (exemple : Ambrette commune (Succinea putris) en Europe).
Le muscle columellaire maintient le gastéropode dans la coquille.
Architecture modifier
« Avec l'Escargot, pas de conflit entre collaborateurs, pas de pénétrations mutuelles entre édifices similaires et voisins. Tout seul, bien isolé, très pacifiquement et sans songer à rien, il accomplit sa rampe transcendante avec de la matière glaireuse chargée de calcaire[4]. »
Comme Jean-Henri Fabre, nombre de naturalistes et de mathématiciens ont été fascinés et se sont interrogés sur la perfection architecturale de la coquille des escargots. Dès le début du XXe siècle, le grand biologiste et mathématicien écossais D'Arcy Wentworth Thompson fut le premier à proposer une formulation mathématique de la forme et de la croissance des coquilles hélico-spirales[5].
Quelle que soit son allure, la coquille est en effet toujours hélicoïdale. C'est sans doute en fin de compte ce qui fait la différence avec les limaces à coquille résiduelle : celle des testacelles par exemple a plutôt l'aspect d'une écaille.
En revanche, la forme est extrêmement variable. Elle peut être très allongée comme chez les Clausiliidae ou, à l'opposé, très globuleuse, presque sphérique, comme chez les espèces consommées d'Europe, le petit-gris et l'escargot de Bourgogne. Tous les intermédiaires sont possibles, et l'on trouve également des espèces dont la coquille est très aplatie, comme celle des Zonitidae.
La coquille de la grande majorité des espèces est dextre, ce qui signifie que l'enroulement de la spire se fait vers la droite. Quelques espèces sont toutefois sénestres : c'est le cas de la plupart des clausiliidés par exemple. Mais il peut également arriver, selon une probabilité généralement très faible, qu'une coquille soit sénestre chez une espèce normalement dextre. Pour déterminer facilement le sens d'enroulement, il suffit de placer l'apex (la pointe) de la coquille vers le haut et son ouverture tournée vers soi : si celle-ci est à droite de l'axe vertical, la coquille est dextre. L'orientation de la coquille est définie par un gène dominant maternel qui gère la morphogenèse chirale responsable de l'orientation oblique des blastomères en division. Cette chiralité, fréquente chez les animaux à déplacement lent[6], pourrait être un facteur clé du succès évolutif des organismes qui est probablement à rechercher dans les possibilités d'adaptation à la reproduction, à la résistance aux prédateurs (crabes qui tiennent plus facilement les coquilles dextres entre les tenailles de leur pince gauche et les broie plus efficacement grâce à la dent de coupe de leur pince droite, plus forte) ou à d'autres facteurs écologiques[7],[8],[9].
L'axe calcaire central, appelé columelle et autour duquel s'enroule le cône calcaire allongé, est plein chez Helix aspersa, creux chez Helix pomatia.
La coquille est dite holostome lorsque le péristome est parfaitement arrondi, siphonostome lorsqu'il présente une encoche ou un canal.
Les tours sont unis les uns aux autres suivant un sillon appelé suture.
Histoire évolutive modifier
L'évolution des gastéropodes s'est effectuée en plusieurs étapes.
Symétrie bilatérale des bilatériens modifier
Les gastéropodes primitifs (plus ou moins apparentés aux amphineures) devaient avoir une masse viscérale et une coquille coniques, dressée verticalement au-dessus de la région céphalo-pédieuse. Mais cette disposition, qui était adaptée à des animaux fouisseurs, a dû se modifier une première fois pour permettre la reptation en surface. Masse viscérale et coquille se sont rabattues vers l'arrière.
À ce stade, le gastéropode a encore une symétrie bilatérale normale.
Torsion modifier
Cette disposition est devenue incommode par suite du resserrement de la cavité palléale entre la masse viscérale et le pied. Alors s'est produite une torsion de 180° en sens inverse des aiguilles d'une montre, qui a ramené la cavité palléale en avant (juste en arrière de la tête).
Conséquence de cette torsion : ploiement en « U » du tube digestif, anus rapproché de la bouche, branchies en avant du cœur, organes de droite passés à gauche et inversement, système nerveux croisé en « 8 ». La symétrie bilatérale est inversée, mais non détruite.
C'est le stade où se sont arrêtés les prosobranches (branchies en avant du cœur), du groupe des diotocardes (qui ont un cœur à deux oreillettes).
Enroulement en spirale modifier
Le corps des gastéropodes, caractérisé par un enroulement intrinsèque lié à une asymétrie du développement musculaire, engendre des contraintes physiques qui favorisent l'enroulement en spirale, à l'inverse des ammonites dont le corps symétrique, rend l'enroulement symétrique ou asymétrique possible[10]. La masse viscérale et la coquille, ne pouvant s'allonger indéfiniment en ligne droite, s'enroulent donc en spirale ou en hélice. L'enroulement a toujours lieu vers le pied (courbe vers l'arrière), et en général, en débordant du côté droit (pointe à droite) : c'est l'enroulement dextre.
Conséquence de cet enroulement : atrophie, puis disparition de l'oreillette, du rein, et de la branchie du côté droit. L'animal devient asymétrique.
C'est le stade où se trouvent les prosobranches monotocardes (à une oreillette) et les pulmonés, qui en dérivent par adaptation à la vie terrestre.
Perte secondaire éventuelle de l'enroulement modifier
Il peut enfin se produire une détorsion et un déroulement, qui font revenir la cavité palléale en arrière du corps. Mais les organes disparus ne réapparaissent pas. L'asymétrie subsiste intérieurement, sinon extérieurement. C'est le stade ultime atteint par les opisthobranches (à branchies en arrière du cœur).
Notes et références modifier
- Benoît Fontaine (biologiste au Muséum national d'Histoire naturelle), « L’escargot », émission La Tête au carré sur France Inter, 29 avril 2014, 16 min 55 s à 17 min 15.
- (en) Mike Hansell, Michael Henry Hansell, Animal architecture, OUP Oxford, , p. 134.
- Frédéric Thomas, Thierry Lefevre, Michel Raymond, Biologie évolutive, De Boeck supérieur, , p. 563.
- Fabre, J.H. (1903). Souvenirs entomologiques. VIIIe Série, chapitre 18.
- Roux, J.B. (2005). La coquille des mollusques. (archive du 23 février 2011, consultée le 21 décembre 2020)
- Chez les animaux à déplacement lent, anatomie interne et morphologie externe (coquille) sont asymétriques alors que chez les animaux à déplacement plus rapide, les asymétries anatomiques fréquentes restent cachées sous une morphologie externe à symétrie presque parfaite.
- (en) M. Schilthuizen, M. Haase, « Disentangling true shape differ-ences and experimenter bias: are dextral and sinistral snail shells exact mirror images? », Journal of Zoollogy, vol. 282, no 3, , p. 191-200 (DOI 10.1111/j.1469-7998.2010.00729.x).
- (en) Takahiro Asami, Robert H. Cowie, Kako Ohbayashi, « Evolution of Mirror Images by Sexually Asymmetric Mating Behavior in Hermaphroditic Snails », The American Naturalist, vol. 152, no 2, , p. 225-236 (DOI 10.1086/286163).
- (en) Y. Shigemiya, « Does the handedness of the pebble crab Eriphia smithii influence its attack success on two dextral snail species? », J. Zool, vol. 260, no 3, , p. 259–265 (DOI 10.1017/S095283690300373X).
- (en) Régis Chirat, Alain Goriely, Derek E. Moulton, « The physical basis of mollusk shell chiral coiling », 2021, vol. 118, no 48, (DOI 10.1073/pnas.2109210118).