Aldolisation
L'aldolisation (appelée aussi cétolisation dans le cadre des cétones) est une réaction de formation de liaisons carbone-carbone importante en chimie organique[1],[2],[3]. Elle implique généralement l'addition nucléophile d'un énolate sur un aldéhyde (ou une cétone), pour former une β-hydroxycétone ou aldol (aldehyde + alcool), une unité structurale présente dans de nombreuses molécules naturelles et médicaments[4],[5],[6]. Parfois, le produit de l'addition aldolique perd une molécule d'eau durant la réaction, pour former une cétone α,β-insaturée. Ceci peut avoir lieu notamment lorsque le produit final est particulièrement stable et le processus (aldolisation + élimination) est appelé crotonisation[7].
La réaction d'aldolisation fut découverte indépendamment par Charles Adolphe Wurtz[8],[9],[10] et Alexandre Porfirievitch Borodine en 1872. Borodine observa la dimérisation du 3-hydroxybutanal avec de l'éthanal (acétaldéhyde) en milieu acide. L'aldolisation est utilisée à grande échelle dans la production de produits chimiques tels que le pentaérythritol[11] et dans l'industrie pharmaceutique pour l'obtention de produits optiquement purs. Par exemple, le chemin de synthèse initial de Pfizer pour le médicament Lipitor (atorvastatine) approuvé en 1996 employait deux réactions aldol[12],[13].
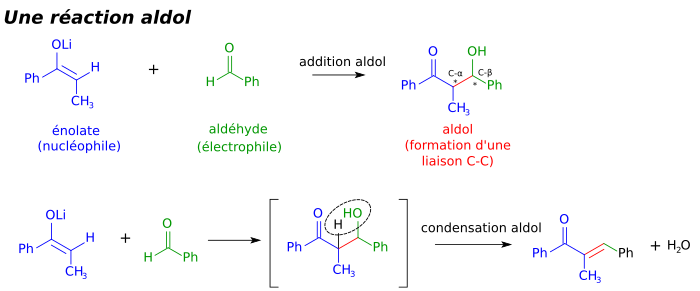
La structure aldol est particulièrement fréquente dans les polycétides, une catégorie de produits naturels à partir de laquelle de nombreux médicaments sont dérivés. Ceux-ci comprennent entre autres l'immunosuppresseur Tacrolimus, l'antibiotique tétracycline et l'antifongique amphotéricine B. Des recherches considérables sur la réaction d'aldolisation ont permis le développement de méthodes efficaces pour la synthèse en laboratoire, autrement ardue, de nombreux polycétides[14]. Ceci est important car beaucoup de polycétides, de même que d'autres molécules biologiquement actives, ne se rencontrent dans la nature qu'en des quantités trop infimes pour une recherche poussée. La synthèse de nombre de ces composés, considérée un temps comme quasi impossible, peut maintenant être effectuée couramment à l'échelle du laboratoire, et approche la viabilité économique dans certains cas, comme le discodermolide, un agent anti-tumoral hautement actif. En biochimie, la réaction d'aldolisation est également une étape-clé de la glycolyse, durant laquelle elle est catalysée par des enzymes appelées aldolases.
La réaction d'aldolisation est particulièrement importante en synthèse organique car elle donne des produits possédant deux nouveaux centres de chiralité (les carbones α et β de l'aldol produit, marqués par des astérisques sur l'image plus haut). Des méthodes récentes permettent désormais le contrôle relatif et absolu de ces centres. Ceci est d'une importance toute particulière dans la synthèse de médicaments, puisque des molécules de même structure mais de stéréochimies différentes ont souvent des propriétés chimiques et biologiques différentes.
Une grande variété de nucléophiles différents peuvent être employés pour la réaction d'aldolisation, incluant les énols, éthers d'énol, et énolates de cétones, d'aldéhydes et d'une grande variété d'autres composés carbonylés. L'électrophile est généralement un aldéhyde, mais de nombreuses variations existent, comme la réaction de Mannich. Quand le nucléophile et l'électrophile sont différents (majorité des cas), la réaction est appelée une aldolisation croisée, contrairement aux dimères formés dans une aldolisation où le même composé joue le rôle d'électrophile et de nucléophile.

Les deux erlenmeyers sont plongés dans un bain de neige carbonique/acétone (−78 °C). La température est contrôlée par un thermocouple (le fil sur la gauche).
Mécanisme modifier
La réaction aldolique peut se faire par le biais de deux mécanismes fondamentalement différents. Les composés carbonylés, tels les aldéhydes et cétones, peuvent être transformés en énols ou éthers d'énol. Ces composés, étant nucléophiles au niveau du carbone α, peuvent attaquer les carbonyles protonés particulièrement réactifs tels que des aldéhydes protonés. Ceci est le mécanisme de type énolique.
Les énols peuvent également être déprotonés pour former des énolates, qui sont bien plus nucléophiles que les énols ou éthers d'énol et peuvent de ce fait attaquer des électrophiles directement. Les électrophiles sont généralement des aldéhydes, puisque les cétones sont moins réactives. Ceci est le mécanisme de type énolate.
Si les conditions de réaction sont particulièrement dures (par exemple : NaOMe, MeOH, chauffage à reflux), la condensation peut avoir lieu. Ceci peut habituellement être évité par l'utilisation de réactifs moins forts et de températures douces (exemple : diisopropylamidure de lithium, THF, −78 °C). Bien que l'addition aldolique soit généralement quasi complète, cette réaction n'est pas irréversible, puisque le traitement des aldols avec des bases fortes peut généralement donner lieu à la réaction inverse (et redonner les réactifs de départ). Les condensations aldoliques sont, quant à elles, irréversibles.
En milieu acide modifier
Quand un catalyseur acide est utilisé, la première étape du mécanisme réactionnel sera la tautomérisation de la fonction carbonyle en l'énol, catalysée par l'acide. L'acide sert également à activer la fonction carbonyle d'une autre molécule par protonation, la rendant plus électrophile. L'énol est le nucléophile, au niveau du carbone α. Il va pouvoir attaquer la molécule portant la fonction carbonyle activée, ce qui donnera l'aldol après une déprotonation. Cet aldol va généralement perdre une molécule d'eau pour donner le composé carbonylé insaturé (crotonisation).
Mécanisme de la réaction aldolique en catalyse acide
Mécanisme de la crotonisation d'un aldol en milieu acide
En milieu basique modifier
Si le catalyseur est une base de force moyenne tel un ion hydroxyde ( ) ou alcoolate ( ), la réaction aldolique va se faire via attaque nucléophile de l'énolate stabilisé par mésomérie sur le groupement carbonyle d'une autre molécule. Le produit formé sera l'alcoolate de l'aldol final. L'aldol lui-même est ensuite formé, et il peut réaliser la crotonisation pour donner le composé carbonylé insaturé. L'image suivante montre le mécanisme de la réaction d'un aldéhyde avec lui-même, en catalyse basique.
Mécanisme de la réaction aldolique en catalyse basique (avec −OCH3 comme base)
Mécanisme de la crotonisation d'un aldol en milieu basique (parfois écrit en une seule étape)
Même si seule une quantité catalytique de base est nécessaire dans certains cas, la méthode usuelle demande l'utilisation d'une quantité stœchiométrique d'une base forte tel le LDA. Dès lors, la formation de l'énolate devient irréversible, et l'aldol n'est pas obtenu avant que l'alcoolate n'ait été protoné lors du processus de parachèvement de la réaction.
Références modifier
- (en) L. G. Wade, Organic Chemistry, Upper Saddle River (New Jersey), Prentice Hall, 2005 (6e éd.) (ISBN 978-0-13-169957-1 et 0-13-169957-1), p. 1056-1066.
- (en) M. B. Smith, J. March, Advanced Organic Chemistry, New York, Wiley Interscience, 2001 (5e éd.) (ISBN 978-0-471-58589-3 et 0-471-58589-0), p. 1218–1223.
- (en) R. Mahrwald, Modern Aldol Reactions, Volumes 1 et 2, Weinheim (Allemagne), Wiley-VCH Verlag GmbH & Co. KGaA, (ISBN 3-527-30714-1), p. 1218–1223.
- (en) C. H. Heathcock, Comp. Org. Syn., Oxford, Pergamon, (ISBN 0-08-040593-2), p. 133–179.
- (en) T. Mukaiyama, « The Directed Aldol Reaction », Org. React., vol. 28, , p. 203-331.
- (en) I. Paterson, « New Asymmetric Aldol Methodology Using Boron Enolates », Chem. Ind., vol. 12, , p. 390-394.
- (en) Stanley H. Pine, Organic Chemistry, McGraw-Hill Book Co., 1987 (ISBN 0-07-100242-1).
- Charles-Adolphe Wurtz, « Sur un aldéhyde-alcool », Bull. Soc. Chim. Fr., vol. 17, , p. 436-442 (lire en ligne, consulté le ).
- Charles-Adolphe Wurtz, « Ueber einen Aldehyd-Alkohol », Journal für praktische Chemie, vol. 5, no 1, , p. 457-464.
- Charles-Adolphe Wurtz, « Sur un aldéhyde-alcool », Comp. Rend., vol. 74, , p. 1361 (lire en ligne).
- (en) R. Mestres, « A green look at the aldol reaction », Green Chemistry, vol. 12, , p. 583–603.
- (en) M. Braun et R. Devant, « (R) and (S)-2-acetoxy-1,1,2-triphenylethanol - effective synthetic equivalents of a chiral acetate enolate », Tetrahedron Letters, vol. 25, , p. 5031–5034.
- (en) Jie Jack Li et al., Contemporary Drug Synthesis, Wiley-Interscience, (ISBN 0-471-21480-9), p. 118.
- (en) B. Schetter et R. Mahrwald, « Modern Aldol Methods for the Total Synthesis of Polyketides », Angewandte Chemie Int. Ed., vol. 45, , p. 7506–7525.