Adénosine désaminase
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | Zn2+ |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
L'adénosine désaminase (ADA), ou adénosine aminohydrolase, aussi appelée désaminase de l'adénosine, est une hydrolase qui catalyse la réaction :
Cette enzyme intervient dans le métabolisme des purines et dans la métabolisation des acides nucléiques. Elle convertit l'adénosine en inosine, qui peut à son tour être clivée en ribose et hypoxanthine par la purine nucléoside phosphorylase.
Présente dans pratiquement toutes les cellules des mammifères, elle intervient avant tout dans le développement et la maintenance du système immunitaire[2]. L'étendue de son rôle physiologique n'est cependant pas encore entièrement compris[3]. On a proposé que, chez l'homme, elle intervienne également dans la différenciation des cellules épithéliales, dans la neurotransmission et la gestation[4]. On a également proposé qu'elle stimule la libération d'acides aminés excitants et quelle soit nécessaire au couplage des récepteurs A1 de l'adénosine et des protéines G hétérotrimériques[3].
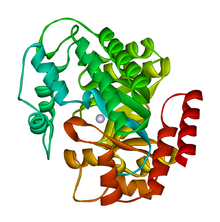
L'adénosine désaminase existe sous deux formes : monomère et dimère[3]. Sous forme monomérique, l'enzyme se présente comme une chaîne polypeptidique[5] repliée en huit tonneaux β entourés par huit hélices α délimitant une poche profonde où se trouve le site actif[2]. Elle contient également trois hélices supplémentaires : les résidus no 19 à 76 se replient en trois hélices situées entre les structures β1 et α1 ; deux hélices antiparallèles supplémentaires de l'extrémité C-terminale sont également situées en travers de l'extrémité N-terminale du tonneaux β. Le site actif contient un cation de zinc Zn2+ enfoui au plus profond de la cavité et coordonnée à la fois au substrat et aux résidus His15, His17, His214 et Asp205 ; l'adénosine interagit dans le site actif à travers neuf liaisons hydrogène[2]. Le zinc est le seul cofacteur nécessaire au fonctionnement de cette enzyme.
C'est l'une des enzymes clé du métabolisme des purines[6]. On la trouve chez les bactéries, les plantes, les invertébrés, les vertébrés et les animaux, avec une séquence peptidique fortement préservée d'une espèce à l'autre[3]. La conservation de cette séquence suggère que l'adénosine désaminase joue un rôle crucial dans la voie de sauvetage des purines.
Notes et références modifier
- (en) Takayoshi Kinoshita, Isao Nakanishi, Tadashi Terasaka, Masako Kuno, Nobuo Seki, Masaichi Warizaya, Hiroyoshi Matsumura, Tsuyoshi Inoue, Kazuhumi Takano, Hiroaki Adachi, Yusuke Mori et Takashi Fujii, « Structural Basis of Compound Recognition by Adenosine Deaminase », Biochemistry, vol. 44, no 31, , p. 10562-10569 (PMID 16060665, DOI 10.1021/bi050529e, lire en ligne)
- (en) D. K. Wilson, F. B. Rudolph et F. A. Quiocho, « Atomic structure of adenosine deaminase complexed with a transition-state analog: understanding catalysis and immunodeficiency mutations », Science, vol. 252, no 5010, , p. 1278-1284 (PMID 1925539, DOI 10.1126/science.1925539, lire en ligne)
- (en) Gloria Cristalli, Stefano Costanzi, Catia Lambertucci, Giulio Lupidi, Sauro Vittori, Rosaria Volpini et Emidio Camaioni, « Adenosine deaminase: Functional implications and different classes of inhibitors », Medicinal Research Reviews, vol. 21, no 2, , p. 105-128 (PMID 11223861, DOI 10.1002/1098-1128(200103)21:2<105::AID-MED1002>3.0.CO;2-U, lire en ligne)
- (en) Yuji Moriwaki, T. Yamamoto et K. Higashino, « Enzymes involved in purine metabolism - A review of histochemical localization and functional implications », Histology and Histopathology, vol. 14, no 4, , p. 1321-1340 (PMID 10506947, lire en ligne)
- (en) P. E. Daddona et W. N. Kelley, « Human adenosine deaminase. Purification and subunit structure », Journal of Biological Chemistry, vol. 252, no 1, , p. 110-115 (PMID 13062, lire en ligne)
- (en) Bertil E. Glader, Karen Backer, et Louis K. Diamond, « Elevated Erythrocyte Adenosine Deaminase Activity in Congenital Hypoplastic Anemia », The New England Journal of Medicine, vol. 309, no 24, , p. 1486-1490 (PMID 6646173, DOI 10.1056/NEJM198312153092404, lire en ligne)
Voir aussi modifier
- Déficit immunitaire combiné sévère par déficit en adénosine désaminase, ou déficit en adénosine désaminase 1
- Adénosine désaminase 2 (ADA2)